Szerző:
Janice Evans
A Teremtés Dátuma:
25 Július 2021
Frissítés Dátuma:
1 Július 2024
Tartalom
Az ionos egyenletek a kémia szerves részét képezik. Csak azokat az összetevőket tartalmazzák, amelyek a kémiai reakció során megváltoznak. Leggyakrabban ionos egyenleteket használnak a redoxreakciók, csere- és semlegesítési reakciók leírására.Az ionos egyenlet megírásához három alapvető lépésre van szükség: egy kémiai reakció molekuláris egyenletének kiegyensúlyozására, teljes ionos egyenletre való lefordítására (vagyis az összetevők felírására, ahogy azok az oldatban vannak), és végül egy rövid ionos egyenlet írására.
Lépések
Rész 1 /2: Az ionos egyenlet összetevői
 1 Értsd meg a különbséget a molekuláris és ionos vegyületek. Az ionos egyenlet megírásához az első lépés a reakcióban részt vevő ionos vegyületek meghatározása. Az ionos anyagok azok, amelyek vizes oldatokban töltött ionokká disszociálódnak (bomlanak). A molekuláris vegyületek nem bomlanak ionokra. Két nemfémes elemből állnak, és néha kovalens vegyületeknek nevezik őket.
1 Értsd meg a különbséget a molekuláris és ionos vegyületek. Az ionos egyenlet megírásához az első lépés a reakcióban részt vevő ionos vegyületek meghatározása. Az ionos anyagok azok, amelyek vizes oldatokban töltött ionokká disszociálódnak (bomlanak). A molekuláris vegyületek nem bomlanak ionokra. Két nemfémes elemből állnak, és néha kovalens vegyületeknek nevezik őket. - Ionvegyületek fordulhatnak elő egy fém és egy nem fém, egy fém és többatomos ionok között, vagy több poliatomikus ion között.
- Ha kétségei vannak azzal kapcsolatban, hogy egy adott vegyület melyik csoportba tartozik, nézze meg alkotóelemeinek tulajdonságait a periódusos rendszerben.
 2 Határozza meg a vegyület oldhatóságát. Nem minden ionos vegyület oldódik fel vizes oldatokban, vagyis nem mindegyik disszociál különálló ionokká. Mielőtt elkezdené írni az egyenletet, meg kell találnia az egyes vegyületek oldhatóságát. Az alábbiakban röviden ismertetjük az oldhatóság szabályait. További részletek és kivételek a szabályban a feloldási táblázatban találhatók.
2 Határozza meg a vegyület oldhatóságát. Nem minden ionos vegyület oldódik fel vizes oldatokban, vagyis nem mindegyik disszociál különálló ionokká. Mielőtt elkezdené írni az egyenletet, meg kell találnia az egyes vegyületek oldhatóságát. Az alábbiakban röviden ismertetjük az oldhatóság szabályait. További részletek és kivételek a szabályban a feloldási táblázatban találhatók. - Kövesse a szabályokat az alábbi sorrendben:
- minden Na, K és NH só4 feloldódik;
- minden só NEM3, C2H3O2, ClO3 és ClO4 oldódó;
- minden Ag, Pb és Hg só2 oldhatatlan;
- minden Cl, Br és I só feloldódik;
- sók CO3, O, S, OH, PO4, CrO4, Cr2O7 és aztán3 oldhatatlan (néhány kivétellel);
- SO sók4 oldható (néhány kivétellel).
 3 Határozza meg a vegyület kationját és anionját! A pozitív töltésű ionokat (általában fémeket) kationoknak nevezik. Az anionok negatív töltéssel rendelkeznek, általában nem fémionok. Egyes nemfémek nemcsak anionokat, hanem kationokat is képezhetnek, míg a fématomok mindig kationként működnek.
3 Határozza meg a vegyület kationját és anionját! A pozitív töltésű ionokat (általában fémeket) kationoknak nevezik. Az anionok negatív töltéssel rendelkeznek, általában nem fémionok. Egyes nemfémek nemcsak anionokat, hanem kationokat is képezhetnek, míg a fématomok mindig kationként működnek. - Például a NaCl (asztali só) vegyületben a Na pozitív töltésű kation, mivel fém, Cl pedig negatív töltésű anion, mivel nem fém.
 4 Határozza meg a reakcióban részt vevő többatomos (komplex) ionokat. Az ilyen ionok töltött molekulák, amelyek atomjai között olyan erős kötés van, hogy kémiai reakciók során nem különülnek el. Szükséges azonosítani a többatomos ionokat, mivel saját töltésük van, és nem bomlanak egyedi atomokká. A poliatomikus ionok pozitív és negatív töltésűek is lehetnek.
4 Határozza meg a reakcióban részt vevő többatomos (komplex) ionokat. Az ilyen ionok töltött molekulák, amelyek atomjai között olyan erős kötés van, hogy kémiai reakciók során nem különülnek el. Szükséges azonosítani a többatomos ionokat, mivel saját töltésük van, és nem bomlanak egyedi atomokká. A poliatomikus ionok pozitív és negatív töltésűek is lehetnek. - Az általános kémia tanfolyamon valószínűleg meg kell jegyeznie néhány leggyakoribb poliatomi iont.
- A leggyakoribb többatomos ionok a CO3, NEM3, NEM2, ÍGY4, ÍGY3, ClO4 és ClO3.
- Számos más polatomikus ion is megtalálható egy kémia tankönyvben vagy az interneten.
2. rész 2: Ionikus egyenletek írása
 1 Kiegyensúlyozza a teljes molekuláris egyenletet. Mielőtt elkezdené írni az ionos egyenletet, meg kell egyensúlyoznia az eredeti molekuláris egyenletet. Ehhez szükséges a megfelelő együtthatókat a vegyületek elé helyezni, úgy, hogy az egyes elemek bal oldalán lévő atomok száma megegyezik az egyenlet jobb oldalán lévő számokkal.
1 Kiegyensúlyozza a teljes molekuláris egyenletet. Mielőtt elkezdené írni az ionos egyenletet, meg kell egyensúlyoznia az eredeti molekuláris egyenletet. Ehhez szükséges a megfelelő együtthatókat a vegyületek elé helyezni, úgy, hogy az egyes elemek bal oldalán lévő atomok száma megegyezik az egyenlet jobb oldalán lévő számokkal. - Írja fel az atomok számát az egyes elemekhez az egyenlet mindkét oldalán.
- Adjon hozzá együtthatókat az elemek elé (kivéve az oxigént és a hidrogént), hogy az egyes elemek atomszáma az egyenlet bal és jobb oldalán azonos legyen.
- Kiegyensúlyozza a hidrogénatomokat.
- Kiegyensúlyozza az oxigénatomokat.
- Számolja meg az egyes elemek atomjainak számát az egyenlet mindkét oldalán, és győződjön meg arról, hogy azonos.
- Például a Cr + NiCl egyenlet kiegyensúlyozása után2 -> CrCl3 + Ni 2Cr + 3NiCl -t kapunk2 -> 2CrCl3 + 3Ni.
 2 Határozza meg a reakcióban részt vevő minden anyag állapotát. Ezt gyakran a probléma állapota alapján lehet megítélni. Vannak bizonyos szabályok, amelyek segítenek meghatározni, hogy egy elem vagy kapcsolat milyen állapotban van.
2 Határozza meg a reakcióban részt vevő minden anyag állapotát. Ezt gyakran a probléma állapota alapján lehet megítélni. Vannak bizonyos szabályok, amelyek segítenek meghatározni, hogy egy elem vagy kapcsolat milyen állapotban van. - Ha egy adott elem állapota nincs feltüntetve a probléma állapotában, használja a periódusos rendszert annak meghatározásához.
- Ha a feltétel szerint a vegyület oldatban van, jelölje meg (rr).
- Ha víz szerepel az egyenletben, akkor az oldhatósági táblázat segítségével határozza meg, hogy az ionos vegyület disszociál -e. Nagy oldhatóság esetén a vegyület vízben disszociál (rr). Ha a vegyület kevéssé oldódik, szilárd marad (tévé).
- Ha a víz nem vesz részt a reakcióban, az ionos vegyület szilárd formában marad (tévé).
- Ha sav vagy bázis jelenik meg a problémában, azokat vízben oldják (rr).
- Példaként tekintsük a 2Cr + 3NiCl reakciót2 -> 2CrCl3 + 3Ni. Tiszta formában a Cr és Ni elemek szilárd fázisban vannak. NiCl2 és CrCl3 oldható ionos vegyületek, azaz oldatban vannak. Így ez az egyenlet a következőképpen írható át: 2Cr(tévé) + 3NiCl2(rr) -> 2CrCl3(rr) + 3Ni(tévé).
 3 Határozza meg, hogy mely vegyületek disszociálnak (kationokká és anionokká válnak szét) az oldatban. A disszociáció után a vegyület pozitív (kationos) és negatív (anion) komponensekre bomlik. Ezek az összetevők ezután belépnek a kémiai reakció ionos egyenletébe.
3 Határozza meg, hogy mely vegyületek disszociálnak (kationokká és anionokká válnak szét) az oldatban. A disszociáció után a vegyület pozitív (kationos) és negatív (anion) komponensekre bomlik. Ezek az összetevők ezután belépnek a kémiai reakció ionos egyenletébe. - Szilárd anyagok, folyadékok, gázok, molekuláris vegyületek, alacsony oldhatóságú ionos vegyületek, poliatomikus ionok és gyenge savak nem disszociálnak.
- Teljesen disszociálja a jól oldódó ionos vegyületeket (használja az oldhatósági táblázatot) és az erős savakat (HCl)(rr), HBr(rr), SZIA(rr), H2ÍGY4(rr), HClO4(rr) és HNO3(rr)).
- Megjegyezzük, hogy bár a poliatomikus ionok nem disszociálnak, beépíthetők az ionos vegyületbe, és oldatban elválaszthatók tőle.
 4 Számítsa ki az egyes disszociált ionok töltését. Ennek során ne feledje, hogy a fémek pozitív töltésű kationokat képeznek, és a nemfém atomok negatív anionokká alakulnak. Határozza meg az elemek töltéseit a periódusos rendszer szerint. Szükséges továbbá az összes töltés kiegyensúlyozása semleges vegyületekben.
4 Számítsa ki az egyes disszociált ionok töltését. Ennek során ne feledje, hogy a fémek pozitív töltésű kationokat képeznek, és a nemfém atomok negatív anionokká alakulnak. Határozza meg az elemek töltéseit a periódusos rendszer szerint. Szükséges továbbá az összes töltés kiegyensúlyozása semleges vegyületekben. - A fenti példában a NiCl2 disszociál Ni -re és Cl -re, valamint CrCl -re3 Cr -re és Cl -re bomlik.
- A nikkelion 2+ töltéssel rendelkezik, mivel két klórionhoz van kötve, mindegyik egyetlen negatív töltéssel. Ebben az esetben egy Ni -ionnak két negatív töltésű Cl -iont kell kiegyensúlyoznia. A Cr ion 3+ töltéssel rendelkezik, mivel három negatív töltésű Cl iont kell semlegesítenie.
- Ne feledje, hogy a poliatomi ionoknak saját töltésük van.
 5 Írja át az egyenletet úgy, hogy minden oldható vegyület különálló ionokká váljon. Minden, ami disszociál vagy ionizál (például erős savak), két különálló ionra bomlik. Ebben az esetben az anyag oldott állapotban marad (rr). Ellenőrizze, hogy az egyenlet kiegyensúlyozott -e.
5 Írja át az egyenletet úgy, hogy minden oldható vegyület különálló ionokká váljon. Minden, ami disszociál vagy ionizál (például erős savak), két különálló ionra bomlik. Ebben az esetben az anyag oldott állapotban marad (rr). Ellenőrizze, hogy az egyenlet kiegyensúlyozott -e. - A szilárd anyagok, folyadékok, gázok, gyenge savak és alacsony oldhatóságú ionos vegyületek nem változtatják meg állapotukat, és nem válnak szét ionokká. Hagyd őket úgy, ahogy voltak.
- A molekuláris vegyületek egyszerűen szétszóródnak az oldatban, és állapotuk oldottra változik (rr). Három molekuláris vegyület létezik nem államba megy (rr), ez CH4(G), C3H8(G) és C.8H18(f).
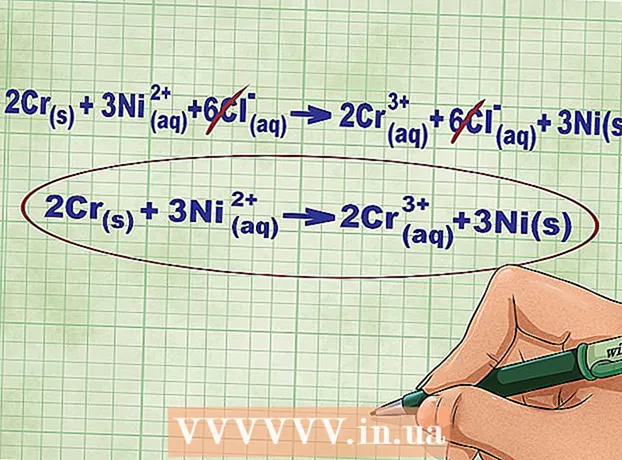
- A vizsgált reakcióhoz a teljes ionos egyenletet a következő formában írhatjuk fel: 2Cr(tévé) + 3Ni(rr) + 6Cl(rr) -> 2Cr(rr) + 6Cl(rr) + 3Ni(tévé)... Ha a klór nem része a vegyületnek, akkor egyes atomokra bomlik, ezért az egyenlet mindkét oldalán 6 -mal megszoroztuk a Cl -ionok számát.
 6 Törölje az egyenlő ionokat az egyenlet bal és jobb oldalán. Csak azokat az ionokat húzhatja át, amelyek az egyenlet mindkét oldalán teljesen azonosak (azonos töltésekkel, előfizetésekkel stb. Rendelkeznek). Írja át az egyenletet ezen ionok nélkül.
6 Törölje az egyenlő ionokat az egyenlet bal és jobb oldalán. Csak azokat az ionokat húzhatja át, amelyek az egyenlet mindkét oldalán teljesen azonosak (azonos töltésekkel, előfizetésekkel stb. Rendelkeznek). Írja át az egyenletet ezen ionok nélkül. - Példánkban az egyenlet mindkét oldala 6 kihúzható Cl -iont tartalmaz. Így kapunk egy rövid ionos egyenletet: 2Cr(tévé) + 3Ni(rr) -> 2Cr(rr) + 3Ni(tévé).
- Ellenőrizze az eredményt. Az ionos egyenlet bal és jobb oldalának összes töltésének egyenlőnek kell lennie.
Tippek
- Képezd magad mindig írja le az összes komponens összesítésének állapotát a kémiai reakciók minden egyenletében.



