Szerző:
Lewis Jackson
A Teremtés Dátuma:
6 Lehet 2021
Frissítés Dátuma:
1 Július 2024
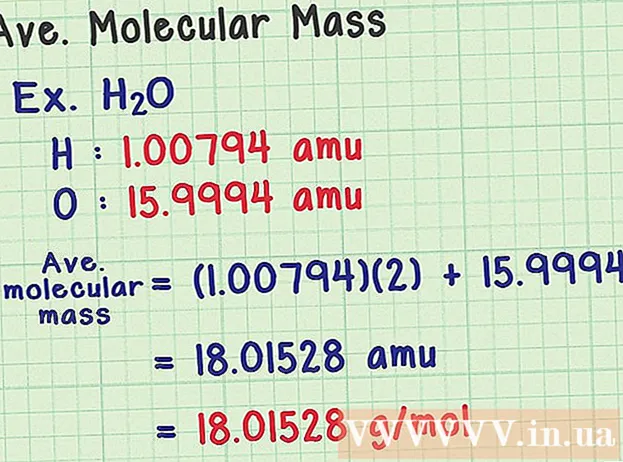
Tartalom
Az átlagos tömegatom nem egy közvetlen mértéke az atom tömegének. Ehelyett ez az elem tipikus mintájának atomonkénti átlagos tömege. Ha meg tudja mérni az egyedi atomok milliárdjainak tömegét, akkor ezt megtudhatja az átlag kiszámításával. Van egy praktikusabb módszerünk, amely a kémiai elem különböző izotópjairól szóló információkon alapul.
Lépések
2. rész: Számítsa ki az átlagos tömegatomot
Ismerje meg az izotópokat és a tömegatomokat. A természetben a legtöbb elem sokféle formában vagy izotópban létezik. Ugyanazon elem két izotópja között az egyetlen különbség az atomban lévő neutronok száma, amelyek neutronjainak száma befolyásolja a tömegatomot. Az átlagos tömegatom kiszámításakor figyelembe veszi ennek a különbségnek a hatását, és megadja az egyes atomok átlagos tömegét az említett atomok mintájában.
- Például az ezüst (Ag) elemnek két természetes izotópja van: Ag-107 és Ag-109 (vagy Ag és Ag). Az izotópot a "tömegszámról", vagyis a protonok számának és az atomban lévő neutronok számának összegéről nevezik el. Ez azt jelenti, hogy az Ag-109-nek még két neutronja van, mint az Ag-107-nek, így atomja kissé nehezebb.

Keresse meg az egyes izotópok tömegét. Minden egyes izotóphoz két információra van szükség, ezeket megnézheti a referenciakönyvekben vagy online, például a webelements.com címen. Az első az egyes izotópok tömegatomja vagy atomtömege. A több neutront tartalmazó izotópok tömege nagyobb.- Például az ezüst Ag-107 izotópnak tömegatomja van 106,90509 amu (egy köbös atom egysége). Az Ag-109 izotóp valamivel nehezebb, tömege 108,90470.
- A végén található tizedespár kissé eltérhet a dokumentumokban. Ne írjon zárójelbe semmilyen számot a mise után.

Írja fel az egyes izotópok természetes túlélési arányát! Ez az arány az izotóp prevalenciáját jelzi, az elem összes atomjának százalékában. Ezeket az információkat ugyanabban a dokumentumban találja, rajta egy köbös atom. Az összes izotóp természetes túlélésének 100% -nak kell lennie (bár a kerekítés hibája miatt kissé eltérhet).- Az Ag-107 izotóp aránya 51,86%. Az Ag-109 izotóp ritkábban fordul elő 48,14% arányban. Ez azt jelenti, hogy egy normál ezüstmintában 51,86% Ag-107 és 48,14% Ag-109 van.
- Azokat az izotópokat, amelyek nem rendelkeznek ezzel a túlélési rátával, figyelmen kívül hagynak. Ezek az izotópok nem léteznek természetes módon a földön.

Konvertálja az izotóp százalékot tizedesre. Ha ezt az arányt elosztjuk 100-mal, akkor a tizedesértékkel megegyező értéket kapunk.- A fenti ezüstmintában az izotópok aránya 51,86 / 100 = 0,5186 és 48,14 / 100 = 0,4814.
Keresse meg az átlagos köbös atomot. Egy elem átlagos tömegatomjának van n izotópok egyenlőek (Atomtömb1. izotóp * arány1. izotóp) + (atomtömeg2. izotóp * arány2. izotóp) + ... + (köbös atomizotópok n * arányizotópok n. Ez az "átlagos tömeg" példája, ami azt jelenti, hogy minél nagyobb az izotóp túlélési aránya, annál nagyobb az hatása az eredményre. Ennek a képletnek az ezüstre való alkalmazása a következő:
- Közepes tömegű atomAg = (köbös atomAg-107 * arányAg-107) + (atomtömegAg-109 * arányAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Az eredmények ellenőrzéséhez keresse meg azt az elemet a periódusos rendszerben. Az átlagos köbatomot mindig az elem kémiai szimbóluma alá írják.
- Közepes tömegű atomAg = (köbös atomAg-107 * arányAg-107) + (atomtömegAg-109 * arányAg-109)
2. rész 2: Az eredmények felhasználása
Konvertálja a tömeget atomszámra. Az átlagos tömegatom megmutatja a tömeg és az atomok számának kapcsolatát az adott elem tipikus mintájában. Ez nagyon hasznos a kémiai laboratóriumokban, mert szinte lehetetlen pontosan megszámolni az atomokat, de a tömegeket könnyű meghatározni. Például megmérhet egy ezüstmintát, és tudja, hogy minden 107,8677 amunként lesz egy ezüstatom.
Konvertálás moláris tömeggé. Az atomi tömegegység nagyon kicsi, ezért a vegyészek gyakran a gramm egységet használják tömegre. Szerencsére meghatároztuk ezeket a fogalmakat, ezért az átalakításnak könnyűnek kell lennie. Csak meg kell szorozni az átlagos tömegatomot 1 g / mol (moláris tömegállandóval), hogy az eredmény g / mol legyen. Például 107 8667 gramm ezüst egy mol ezüstatomot tartalmaz.
Keresse meg az átlagos molekulatömeget. Mivel a molekula atomok gyűjteménye, hozzáadhatja az összes atom tömegét, hogy megtalálja a molekulatömeget. Ha átlagos tömegatomot használna (egy adott izotóp tömege helyett), az eredmény egy minta átlagos molekulatömege lenne a természetben. Íme egy példa:
- Egy vízmolekula kémiai képlete H2Az O két hidrogénatomot (H) és egy oxigénatomot (O) tartalmaz.
- A hidrogén átlagos tömegatomja 1,00794 amu. Az oxigén átlagos atomtömege 15,9994 amu.
- Tehát a H átlagos molekulatömege2O értéke (1,00794) (2) + 15,9994 = 18,01528 amu, ami 18,01528 g / mol-nak felel meg.
Tanács
- A relatív atomtömeg fogalmát néha egy átlagos tömegatom szinonimájaként használják. Van egy kis különbség, mert az atomtömeg viszonylag egységnyi; ez a tömeg mérése egy szén-12 atomhoz viszonyítva. Amíg az atomi tömegegységet használja az átlagos köbatom számításban, ez a két érték megegyezik.
- A köbös atom után zárójelben lévő szám megmondja a hibát. Például az 1.0173 (4) tömegatom azt jelenti, hogy az elem normál atomjának tömegtartománya körülbelül 1.0173 ± 0.0004. Nem kell megszereznie ezt a számot, ha nem kéri.
- A periódusos rendszerben a következő elem átlagos köbatomja nagyobb, mint az előtte levő, kevés kivételtől eltekintve. Ez egy gyors módja az eredmények ellenőrzésének.
- 1 atomtömegegység a 12-es szénatom 1/12 tömege.
- Az izotóp túlélési arányait a földön jellemzően előforduló természetes minták szerint számolják. A nem természetben előforduló anyagok, például a meteoritok vagy a laboratóriumban előállított anyagok izotóparánya eltérő lehet, ezért az átlagos tömegatom is eltérő.
Figyelem
- A tömegatomokat mindig atomtömegegységekben (amu vagy u) írják, néha daltonoknak (Da) nevezik. Soha ne írjon más tömegegységet (például egy kilogrammot) e szám után anélkül, hogy megváltoztatná.
Amire szükséged van
- Ceruza
- Papír
- Laptop
- Az izotóp túlélési arányának adatai a természetben.
- Izotópok atomtömeg-adatai.