Szerző:
Randy Alexander
A Teremtés Dátuma:
1 Április 2021
Frissítés Dátuma:
1 Július 2024
Tartalom
A kémia területén vegyérték elektronok az elektron elektronhéjának legkülső rétegében elhelyezkedő elektronok. Az elem vegyértékelektronjainak meghatározása fontos technika a kémia területén, mivel ezek az információk segítenek meghatározni az elem által képződhető kötések típusait. A vegyérték elektronok számának meghatározása a kémiai elemek periódusos rendszerével könnyen elvégezhető.
Lépések
1/2 rész: Keresse meg a vegyérték elektronok számát a periódusos rendszer segítségével
Nem átmeneti fémmel
Készítsen egyet periódusos táblázat kémiai elemek. Az elemek periódusos táblája (röviden a periódusos rendszer) egy színkódolt többcellás tábla, amely felsorolja az összes ismert elemet, valamint néhány alapvető információt azokat az elemeket. A periódusos rendszerben rendelkezésre álló információk alapján meghatározhatjuk az általunk vizsgált elem vegyértékelektronjainak számát. A periódusos rendszer általában egy tankönyvhez van csatolva. Hivatkozhat erre a meglévő interaktív időszakos táblázatra is.

Számozza meg a periódusos rendszer minden oszlopát 1-től 18-ig. Általában a periódusos rendszerben ugyanazon oszlop összes elemének azonos számú vegyértékelektronja lesz. Ha a periódusos rendszer még nem rendelkezik oszlopokkal, tegye meg úgy, hogy balról jobbra függőlegesen számozza az 1-től 18-ig. Tudományosan a periódusos rendszer minden oszlopát egynek nevezzük "csoport".- Például egy aláíratlan periódusos rendszer esetén az 1-es számot a Hydrogen (H) elem fölé, a 2-es számot a Beri (Be) elem fölé tesszük, és ugyanezt tesszük 18-ig a hélium felett (He ).

Határozza meg a kérdéses elem helyzetét. Ebben a lépésben határozza meg annak az elemnek a helyzetét, amelyet a periódusos rendszerben néz. Megtalálhatja az elem helyzetét kémiai szimbóluma (betű az egyes cellákban), atomszám (az egyes cellák bal felső sarkában lévő szám) vagy információk alapján. üzenetek érhetők el a periódusos rendszerben.- Például meg kell találnunk az elem vegyértékelektronjainak számát Szén (C). Az elem atomszáma 6. A szén a 14. elem felső részében található, a következő lépésben meghatározzuk ennek az elemnek a vegyértékelektronjait.
- Ebben a szakaszban figyelmen kívül hagyjuk az átmeneti fémeket, azaz a 3–12. Csoportba tartozó elemeket. Ezek az átmenetifémek kissé eltérnek a többitől, ezért a lépéseket Az ebben a részben megadott utasítások nem vonatkoznak az ilyen fémekre. Ezeket az elemcsoportokat később a cikkben fogjuk megvizsgálni.

Használja a csoport számát a vegyérték elektronok számának meghatározásához. Egy nem átmeneti fém csoportszámával kiszámolható az adott elem atomjában lévő vegyérték elektronok száma. A "csoportszám egységsora" az adott csoport elemeinek atomjaiban jelen lévő vegyérték elektronok száma. Más szavakkal:- 1. csoport: 1 vegyérték elektron
- 2. csoport: 2 vegyérték elektron
- 13. csoport: 3 vegyérték elektron
- 14. csoport: 4 vegyérték elektron
- 15. csoport: 5 vegyérték elektron
- 16. csoport: 6 vegyérték elektron
- 17. csoport: 7 vegyérték elektron
- 18. csoport: 8 vegyértékű elektron (kivéve a 2 vegyértékű elektronnal rendelkező héliumot)
- A szén példában, mivel a szén a 14. csoportba tartozik, azt mondhatnánk, hogy egy szénatomnak van négy vegyérték elektron.
Átmenetifémmel
Azonosítson egy elemet a 3. csoporttól a 12. csoportig. Amint azt fentebb említettük, a 3–12. Csoportba tartozó elemeket „átmenetifémeknek” nevezik, és ha valencia elektronokról van szó, ezeknek a tulajdonságai eltérnek a többitől. Ebben a szakaszban megtudhatjuk, miért nem lehet valence elektronokat rendelni az átmenetifémek atomjaihoz.
- Ebben a részben példaként a Tantan (Ta) elemet vesszük, amelynek atomszáma 73. A következő lépések segítenek meghatározni az elem vegyértékelektronjainak számát.
- Megjegyezzük, hogy a három család lantán és aktinium (más néven "ritkaföldfémek") elemei szintén az átmenetifémek csoportjába tartoznak - ez a két elemcsoport általában a periódusos rendszer alatt található. fej lantánnal és aktinival.
Az átmenetifémekben lévő vegyérték elektronok nem azonosak a „normál” vegyérték elektronokkal. Annak megértéséhez, hogy az átmenetifémek miért nem "működnek", mint a periódusos rendszer többi elemei, tudnunk kell egy kicsit arról, hogy az elektronok hogyan működnek az atomban, az alábbiakban kifejtettek szerint. , vagy kihagyhatja ezt a lépést.
- Ha az elektronokat beillesztik egy atomba, akkor különböző "pályákra" - a mag körül különböző régiókra - rendeződnek. Röviden: a vegyérték elektronok a legkülső pályán elhelyezkedő elektronok - más szóval: az atomhoz hozzáadott utolsó elektronok.
- A pálya részletes magyarázata talán kissé bonyolult, amikor elektronokat adunk az alosztályhoz d az átmeneti fém atomhéjának (lásd alább), az első ilyen elektron normális vegyértékű elektronként fog viselkedni, de akkor tulajdonságaik megváltozhatnak amikor más pályákról érkező elektronok valens elektronként működhetnek. Vagyis az atomnak az esettől függően több vegyértékű elektronja lehet.
- Tudjon meg többet erről a Clackamas Közösségi Főiskola valence elektron webhelyén.
Határozza meg a vegyérték elektronok számát a csoportszám alapján. Amint azt a nem átmeneti fémeknél fentebb megjegyeztük, a periódusos rendszerben szereplő csoportszám segíthet meghatározni a vegyértékes elektronok számát. Az átmeneti fém vegyértékelektronjainak pontos számának meghatározásához azonban nincs határozott képlet - ebben az esetben egy elem vegyértékelektronjainak száma nem rögzített értéken van, a dolgok száma. az éncsoportok csak relatív számú vegyértékelektront tudnak megmondani. Részlet:
- 3. csoport: 3 vegyérték elektron
- 4: 2 - 4 vegyértékű elektron csoportjai
- 5. csoport: 2–5 vegyértékű elektron
- 6. csoport: 2–6 vegyértékű elektron
- 7. csoportok: 2-7 vegyérték elektron
- 8: 2 - 3 vegyértékű elektroncsoportok
- 9. csoportok: 2-3 vegyérték elektron
- 10: 2-től 3-ig terjedő vegyértékű elektroncsoportok
- 11. csoportok: 1-2 vegyértékű elektron
- 12. csoport: 2 vegyérték elektron
- Az 5. csoport Tanta (Ta) elemének példájára azt mondhatjuk, hogy ennek az elemnek van 2-5 vegyértékű elektron, az esettől függően.
2/2 rész: Keresse meg a vegyérték elektronok számát az elektronkonfiguráció alapján!
Tanulja meg, hogyan kell olvasni az elektronkonfigurációt. Egy elem elektronkonfigurációja alapján meghatározhatjuk az adott elem vegyértékelektronjainak számát is. Az elektronkonfiguráció bonyolultnak tűnik, de csak így lehet egy elem pályáját betűk és számok formájában ábrázolni, miután megértette a törvényt, az elektronkonfiguráció megértése nem nehéz.
- Vegyünk egy példát a nátrium (Na) elektronkonfigurációjára:
- 1s2s2p3s
- Ha odafigyel, látni fogja, hogy az elektronkonfiguráció csak ismétlések sora:
- [szám] [szó] [szám] [szó] ...
- ... stb. Csoport (szám) (szó) az első a pálya neve, és jelöli az adott pályán lévő elektronok számát.
- Tehát esetünkben elmondhatjuk, hogy a nátrium igen 2 elektron az 1s pályán, 2 elektron a 2s pályán, 6 elektron egy 2p pályán és 1 elektron 3 3s pályán. Összesen 11 elektron van - a nátrium atomszáma is 11.
- Vegyünk egy példát a nátrium (Na) elektronkonfigurációjára:
Keresse meg a keresett elem elektronkonfigurációját. Miután megismerte egy elem elektronkonfigurációját, nem nehéz megtalálni az elem elektronkonfigurációját (kivéve az átmenetifémeket). Ha az elektronkonfiguráció elérhető a megoldandó kérdésben, akkor ezt a lépést kihagyhatja. Ha meg kell találnia az elektronkonfigurációt, hajtsa végre a következő lépéseket:
- Az ununocti (Uuo) elem, a 118-as atom teljes elektronkonfigurációja:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Ha ilyen teljes elektronkonfigurációval rendelkezik, akkor egy másik elem elektronkonfigurációjának megtalálásához csak be kell töltenie a pályákat elektronokkal, kezdve az első pályával, amíg az elektronok száma el nem fogy. Bonyolultnak hangzik, de amikor ezt meg kell tenni, viszonylag könnyű. Például, ha meg akarjuk írni a klór (Cl), a 17. elem teljes elektronkonfigurációját, vagyis ennek az elemnek 17 elektronja van, akkor a következőket töltjük ki:
- 1s2s2p3s3p
- Ne feledje, hogy az elektronkonfigurációban lévő elektronok teljes száma pontosan megfelelő: 17: 2 + 2 + 6 + 2 + 5 = 17. Csak meg kell változtatnia az utolsó pálya számát - a többi ugyanaz marad, mert a közeli előtti előtti pálya megtelt. elektron.
- Tudjon meg többet az elem elektronkonfigurációjának megírásáról.
- Az ununocti (Uuo) elem, a 118-as atom teljes elektronkonfigurációja:

Rendeljen elektronokat a pályákra a nyolcadik szabály szerint. Amikor az elektronokat hozzáadjuk egy atomhoz, azokat a fenti sorrendben pályákra rendezzük - az első két elektron az 1s, a következő két elektron a 2s, a következő hat elektron pedig a pályára kerül. 2p, addig csináld, amíg az elektron be nem kerül a megfelelő pályára. Ha figyelembe vesszük a nem átmeneti elemek atomjait, akkor azt mondhatjuk, hogy ezek a pályák "rétegeket" alkotnak a mag körül, amelyekben a hátsó réteg távolabb lesz a magtól, mint az előtte lévő. Az első, legfeljebb két elektron befogadására képes pályaréteg mellett az összes következő pályaréteg akár nyolc elektron is (az átmenetifémek kivételével). Ezt a szabályt nevezzük A nyolcszoros szabály.- Vegyük például a Bo (B) elemet. Ennek az elemnek az atomszáma 5, tehát ennek az elemnek az elektronkonfigurációja a következő: 1s2s2p. Mivel az első pályahéj csak 2 elektront tartalmaz, meg lehet állapítani, hogy Bo két pályaréteggel rendelkezik: az első az 1s pályán 2 elektronból áll, a második pedig a 2s és 2p pályákon elosztott három elektronból áll. .
- Egy másik példa: a klórhoz hasonló elemnek 3 rétege lenne: egy két elektronból álló réteg az 1s pályán, egy két elektron réteg a 2s pályán és hat elektron a 2p pályán, és egy külső réteg két elektronból a 3s pályán. és öt elektron egy 3p pályán.

Keresse meg a legkülső rétegben lévő elektronok számát. Miután meghatároztuk az elektronkonfigurációt, már ismerjük az elem rétegeit, a vegyértékes elektronok számának megállapítása az atomelektronhéj legkülső rétegében lévő elektronok számának meghatározásával történhet. Ha a legkülső réteg megtelt (azaz már összesen nyolc elektron van, vagy az első réteg esetében 2 elektron), akkor ezt az elemet inert elemnek nevezzük, és alig vesz részt kémiai reakciókban. Ez a szabály azonban nem vonatkozik az átmenetifémekre.- Például a Bo elemnél, mivel Bo második elektront tartalmaz a második rétegben, a legkülső réteget is, azt mondhatjuk, hogy a Bo apa vegyérték elektronok.

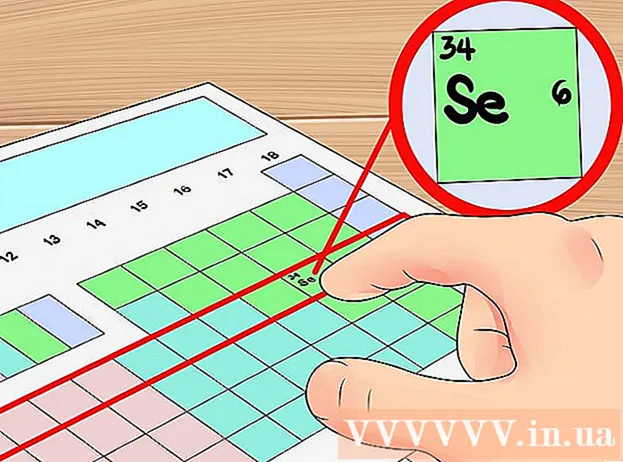
Használja a periódusos rendszer sorszámát rövidített módszerrel a keringési rétegek számának meghatározásához. A periódusos rendszer vízszintes sorát hívjuk "ciklus" az elemek közül. Az első sorból kiindulva minden ciklus megfelel az elemek 'elektronrétegek számának' ugyanabban az időszakban. Ezért a periódus segítségével gyorsan meghatározhatja az elem vegyértékelektronjainak számát - csak az elektronok számát számolja sorrendben balról jobbra az adott periódus első elemétől számítva. Még egyszer vegye figyelembe, hogy ez nem alkalmazható átmenetifémekre.- Például, mivel a szelén a 4. ciklushoz tartozik, meghatározható, hogy az elemnek az atomhéjban négy elektronrétege van. Mivel balról jobbra sorrendben ez a hatodik elem a 4. ciklusban (az átmeneti fém kivételével), azt mondhatjuk, hogy a szelén negyedik héja hat elektronral rendelkezik, vagyis ez az elem hat vegyérték elektron.
Tanács
- Megjegyezzük, hogy az elektronkonfiguráció röviden megírható ritka gázokkal (a 18. csoport elemei), a konfiguráció tetején található pályák helyett. Például a nátrium elektronkonfigurációja 3s1-ként írható fel - vagyis a nátrium elektronkonfigurációja megegyezik a Neonéval, de van egy extra elektron a 3s pályán.
- Az átmenetifémeknek hiányos valencia-alosztályai lehetnek. Az átmenetifém vegyértékének pontos meghatározásához összetett kvantumelveket kell alkalmazni, amelyekre ez a cikk nem terjed ki.
- Fontos megjegyezni azt is, hogy a kémiai elemek periódusos rendszere különböző lehet az egyes országokban. Tehát mindenképpen használja a közös periódusos rendszert, ahol él, hogy elkerülje a zavart.
Amire szükséged van
- A kémiai elemek periódusos táblázata
- Ceruza
- Papír