Szerző:
Lewis Jackson
A Teremtés Dátuma:
12 Lehet 2021
Frissítés Dátuma:
1 Július 2024
Tartalom
Elektronkonfiguráció egy atom az elektronpályákat képviselő számsor. Az elektronobitánok az atommagot körülvevő, különböző alakú térbeli régiók, amelyekben az elektronok rendezetten vannak elrendezve. Az elektronkonfiguráció segítségével gyorsan meghatározhatja, hogy hány elektronpálya van az atomban, és az elektronok számát az egyes pályákon. Miután megértette az elektronkonfiguráció alapelveit, képes lesz megírni saját elektronkonfigurációját, és kémiai vizsgálatokat is magabiztosan elvégezni.
Lépések
1/2 módszer: Határozza meg az elektronok számát egy kémiai periódusos rendszer segítségével
Keresse meg az atom atomszámát. Minden atomhoz meghatározott számú elektron kapcsolódik. Keresse meg az elemet a periódusos rendszerben. Az atomszám egy pozitív egész szám, amely 1-től kezdődik (hidrogén esetén), és minden egyes atom után 1-gyel növekszik. Az atomszám az atom protonjainak száma - tehát az atom alapállapotú elektronjainak száma is.
- Határozza meg az atom töltését. Az elektromosan semleges atomnak megfelelő számú elektronja van, mint azt a periódusos rendszer mutatja. A töltéssel rendelkező atomnak azonban a töltés nagysága alapján többé-kevésbé lesz elektronja. Ha töltéssel rendelkező atomokkal dolgozik, adja hozzá vagy vonja le a megfelelő számú elektronot: minden negatív töltéshez adjon hozzá egy elektront, és minden pozitív töltéshez vonjon le egy elektront.
- Például egy +1 töltésű nátriumatomnál egy elektron eltávolításra kerül a bázis 11-es atomszámról. Ezért a nátriumatomnak összesen 10 elektronja lesz.
- Jegyezze meg az alapvető pályarendet. Amikor egy atom elektronokat fogad, akkor ezek az elektronok meghatározott sorrendben pályákra rendeződnek. Amikor az elektronok kitöltik a pályákat, az egyes pályákon az elektronok száma páros. A következő pályák vannak:
- Obitan s (bármely olyan szám, amelynek az elektronkonfigurációja mögött "s" van), csak egy pályája van, és kövesse Az elv Pauli kivételévelMinden pálya maximum 2 elektronot tartalmaz, tehát minden pályája csak 2 elektronot tartalmaz.
- Obitan p 3 pályája van, tehát akár 6 elektron is képes befogadni.
- Obitan d 5 pályája van, tehát akár 10 elektron is képes befogadni.
- Obitan f 7 pályája van, így akár 14 elektron is képes tárolni. Jegyezze meg a pályák sorrendjét a következő fülbemászó mondat szerint:
Stovább Pagresszív Duh Foké Gzsibbadt HHoppá ÍKJövök.
A több elektronot tartalmazó atomok esetében a pályák továbbra is ábécé sorrendben vannak felírva a k betű után, kihagyva a használt karaktereket.
- Az elektronkonfiguráció megértése. Az elektronkonfigurációkat úgy írják meg, hogy egyértelműen megmutassák az atomban lévő elektronok számát, valamint az egyes pályákon található elektronok számát. Minden pálya meghatározott sorrendben van megírva, az egyes pályákon található elektronok számával a pálya neve jobb oldalán felül. Végül az elektronkonfiguráció egy olyan szekvencia, amely a pályák nevéből és a tőlük jobbra fentebb írt elektronok számából áll.
- A következő példa egy egyszerű elektronkonfiguráció: 1s 2s 2p. Ez a konfiguráció azt mutatja, hogy két elektron van az 1s pályán, két elektron a 2s pályán, és hat elektron a 2p pályán. 2 + 2 + 6 = 10 elektron (összesen). Ez az elektronkonfiguráció egy elektromosan semleges neon atomra vonatkozik (a neon atomszáma 10).
- Jegyezze meg a pályák sorrendjét. Ne feledje, hogy a pályák az elektronosztály szerint vannak megszámozva, de energetikailag vannak rendezve. Például a 4s pálya alacsonyabb energiával telített (vagy tartósabb), mint a telített vagy telítetlen 3d pálya, ezért először a 4s alosztályt írjuk. Miután megismerte a pályák sorrendjét, az elektronokat az atom elektronjainak száma szerint rendezheti el bennük. Az elektronok pályákra történő sorrendje a következő: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Az atomok elektronkonfigurációja az egyes elektronokkal töltött pályákkal így íródott: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Vegye figyelembe, hogy ha az összes réteg meg van töltve, akkor a fenti elektronkonfiguráció Og (Oganesson) 118-as konfigurációja, amely a periódusos rendszer legmagasabb számú atomja - amely tartalmazza az összes jelenleg ismert elektronréteget a elektromosan semleges atomgal.
- Rendezze az elektronokat pályákra az atomban lévő elektronok száma szerint. Például, ha meg akarja írni az elektromosan semleges kalciumatom elektronkonfigurációját, az első dolog, hogy megtalálja atomszámát a periódusos rendszerben. A kalcium atomszáma 20, ezért a 20 sorrendű atom konfigurációját a fenti sorrendben írjuk meg.
- Tegye elektronjait a pályákra a fenti sorrendben, amíg el nem éri a 20 elektront. Obitan 1s kap két elektronot, 2s kettőt, 2p hatot, 3s kettőt, 3p hatot és 4s kettőt (2 + 2 + 6 +2 +6 + 2 = 20). Ezért a kalcium elektronkonfigurációja: 1s 2s 2p 3s 3p 4s.
- Megjegyzés: Az energiaszint az elektronréteg növekedésével változik. Például, amikor a 4. energiaszintre ír, először a 4s alosztályt írják, a későbbiekben 3d-re. A negyedik energiaszint megírása után továbblép az ötödik szintre, és újrakezdi a rétegrendet. Ez csak a 3. energiaszint után következik be.
- Használja a periodikus táblázatot vizuális parancsikonként. Észrevehette, hogy a periódusos rendszer alakja megfelel az elektronkonfigurációban található pályák sorrendjének. Például a második bal oldali oszlop atomjai mindig "s" -re, a középső szakasz jobb szélén lévő atomok mindig "d" -re végződnek. Stb. ábra - az elektronok pályákra helyezésének sorrendje meg fog egyezni a periódusos rendszerben látható pozíciókkal. Lásd lentebb:
- A két bal oldali oszlop olyan atom, amelynek elektronkonfigurációja az s pályán végződik, a periódusos rendszer jobb oldala atomok, amelyeknek elektronkonfigurációja végződik a p pályára, a középső rész pedig atomok, amelyek az s pályán végződnek. d, és alatta vannak az f pályára végződő atomok.
- Például a klór elektronkonfigurációjának megírásakor tegye a következő érvet: Ez az atom a periódusos rendszer harmadik sorában (vagy "periódusában") található. A periódusos rendszer p orbitális blokkjának ötödik oszlopában is szerepel. Tehát az elektronkonfiguráció a végén lesz ... 3p.
- Óvatos! A periódusos rendszer d és f orbitális osztályai megfelelnek a periódusuktól eltérő energiaszinteknek. Például a d pályasorozat első sora a 3d pályának felel meg, annak ellenére, hogy a 4. periódusban van, míg az f pálya első sora a 4f pályának felel meg, annak ellenére, hogy a 6. periódusban van.
- Ismerje meg, hogyan lehet összeállítható elektronkonfigurációkat írni. A periódusos rendszer jobb szélén lévő atomokat hívjuk ritka gáz. Ezek az elemek kémiailag nagyon inertek. A hosszú elektronkonfigurációk megírásának rövidítése érdekében írjon szögletes zárójelbe a legközelebbi ritka gáz kémiai szimbólumát, amelynek kevesebb elektronja van, mint az atoménak, majd írja tovább a következő pályák elektronkonfigurációit. . Lásd lentebb:
- Ennek a koncepciónak a megértéséhez írjon egy példa összeomlott elektronkonfigurációját. Tegyük fel, hogy egy ritka gázkonfiguráción keresztül meg kell írnunk a cink-redukció elektronkonfigurációját (30. atomszám). A cink teljes elektronkonfigurációja: 1s 2s 2p 3s 3p 4s 3d. Megjegyezzük azonban, hogy 1s 2s 2p 3s 3p a ritka agonikus gáz konfigurációja. Csak cserélje le a cink elektron jelölésének ezt a részét a szögletes zárójelben lévő agonikus kémiai szimbólumra ().
- Ezért a cink elektronkonfigurációja kompakt 4s 3d.
2/2 módszer: Az ADOMAH periódusos rendszer használata

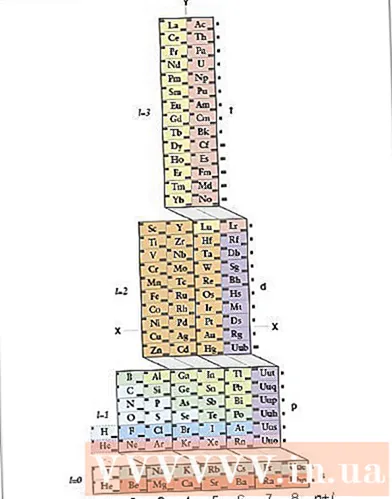
Fedezze fel az ADOMAH periódusos rendszerét. Az elektronkonfiguráció írásának ez a módja nem igényel memorizálást. Ehhez a módszerhez azonban át kell rendezni a periódusos rendszert, mert egy szabályos periódusos rendszerben a negyedik sor óta a ciklusok száma nem felel meg az elektronrétegnek. Keressen egy ADOMAH periódusos rendszert, egy speciális kémiai periódusos rendszert, amelyet Valery Tsimmerman tudós tervezett. Ezt az időszakos táblázatot megtalálhatja az interneten.- Az ADOMAH periódusos rendszerben a vízszintes sorok olyan elemcsoportok, mint halogének, inert gázok, alkálifémek, alkáliföldfémek stb. A függőleges oszlopok az elektronrétegnek felelnek meg, és "lépcsőknek" (átlós kereszteződéseknek) nevezik őket. az s, p, d és f) blokkok megfelelnek a periódusnak.
- A hélium a hidrogén mellett helyezkedik el, mert mindkettőnek egyedi 1-es pályája van. A periódusos blokkok (s, p, d és f) a jobb oldalon, az elektronrétegek száma pedig az alapon láthatók. Az elemek nevét 1-től 120-ig számozott téglalapba írják. Ezek a számok a szokásos atomszámok, amelyek az elektromosan semleges atomban lévő elektronok teljes számát jelentik.
- Keresse meg az elemeket az ADOMAH periódusos rendszerben. Egy elem elektronkonfigurációjának megírásához keresse meg annak szimbólumát az ADOMAH periódusos rendszerben, és húzza ki az összes elemet, amelynek nagyobb az atomszáma. Például, ha meg akarja írni az eribi (68) elektronkonfigurációját, húzza ki a 69–120 elemeket.
- Jegyezze fel az 1–8 számokat a periódusos rendszer alján. Ez az elektronrétegek vagy oszlopok száma. Ne figyeljen olyan oszlopokra, amelyek csak elemeket húztak ki.Az eribi esetében a fennmaradó oszlopok 1, 2, 3, 4, 5 és 6.
- Számolja meg a pályák számát az atom helyzetébe a konfiguráció megírásához. Nézze meg a periódusos tábla jobb oldalán látható blokk szimbólumot (s, p, d és f), és nézze meg a táblázat alján látható oszlopok számát, függetlenül a blokkok közötti átlós vonalaktól, ossza oszlopokat oszlopokra-blokkokra és írjon alulról felfelé rendben vannak. Csak áthúzott elemeket tartalmazó oszlopblokkok kihagyása. Írja fel az oszlop blokkokat az oszlop számával kezdve, majd a blokk szimbólumot, így: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (eribi esetén).
- Megjegyzés: Az Er fenti elektronkonfigurációját az elektronrétegek számának növekvő sorrendjében írjuk. Ez a konfiguráció felírható az elektronok pályákra helyezésének sorrendjében is. Oszlopblokkok írásakor kövesse az oszlopok helyett fentről lefelé haladó lépéseket: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Számolja meg az orbitális elektronok számát. Számolja meg az egyes oszlopblokkokban nem áthúzott elektronok számát, rendeljen elemenként egy elektront, és írja le az elektronok számát a blokk szimbólum mellé minden blokkoszlophoz, így: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Ebben a példában ez az eribi elektronkonfigurációja.
- Ismerje fel a rendellenes elektronkonfigurációkat. Tizennyolc általános kivétel van a legalacsonyabb energiaállapotú atomok elektronkonfigurációja alól, más néven alapállapot. Az általános ökölszabályhoz képest csak az utolsó két-három elektronpozíciótól térnek el. Ebben az esetben a tényleges elektronkonfiguráció miatt az elektronok energiaállapota alacsonyabb, mint az atom szokásos konfigurációja. A szokatlan atomok a következők:
- Kr. | (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) és Cm (..., 5f7, 6d1, 7s2).
Tanács
- Ha az atom ion, az azt jelenti, hogy a protonok száma nem egyenlő az elektronok számával. Az atom töltése az elem szimbólumának (általában) jobb felső sarkában látható. Ezért a +2 töltésű antimon atom elektronkonfigurációja 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Vegye figyelembe, hogy az 5p érték 5p-re változik. Legyen óvatos, ha az elektromosan semleges atom konfigurációja az s és p kivételével bármelyik pályán végződik. Az elektronok eltávolításával csak a vegyértékpályákról (s és p pályákról) lehet elektronokat venni. Tehát, ha egy konfiguráció 4s 3d-re végződik, és az atom töltése +2, akkor a konfiguráció 4s 3d-re változik. A 3d-t látjukállandó, de csak az s pályán lévő elektronok távolulnak el.
- Minden atom általában stabil állapotba kerül, és a legstabilabb elektronkonfigurációnak elegendő s és p pályája lesz (s2 és p6). Ezeknek a ritka gázoknak ez az elektronkonfigurációja, ezért ritkán vesznek részt a reakciókban, és a periódusos rendszer jobb oldalán vannak. Tehát, ha egy konfiguráció 3p-nél végződik, csak még két elektron hozzáadása szükséges ahhoz, hogy stabil legyen (hat elektron leadása, beleértve az s pálya elektronjait is, több energiát igényel, így négy elektron leadása könnyű lenne. könnyebb). Ha egy konfiguráció 4d-nél végződik, akkor csak három elektronra van szüksége ahhoz, hogy elérje a stabil állapotot. Hasonlóképpen, az új alosztályok, amelyek befogadják az elektronok felét (s1, p3, d5 ..), stabilabbak, pl. P4 vagy p2, de s2 és p6 még stabilabbak lesznek.
- A valencia elektronkonfigurációval felírhatja egy elem elektronkonfigurációját is, amely az utolsó s és p pálya. Ezért az antimonatom vegyértékkonfigurációja egy antimon esetében 5s 5p.
- Az ionok nem úgy néznek ki, mert sokkal tartósabbak. Hagyja ki a cikk fenti két lépését, és ugyanúgy működjön, attól függően, hogy hol indul, és hány vagy kevesebb elektron van.
- Ha meg akarja találni az atomszámot az elektronkonfigurációjából, adja hozzá az összes számot, amely a betűket követi (s, p, d és f). Ez csak akkor helyes, ha semleges atom, ha ion, akkor nem használhatja ezt a módszert. Ehelyett hozzá kell adni vagy levonni a befogadott vagy leadott elektronok számát.
- A betűt követő számot a jobb felső sarokba kell írni, a teszt elvégzése során nem szabad helytelenül írni.
- Az elektronkonfigurációk kétféle módon írhatók. Írhat az elektronréteg növekvő sorrendjében, vagy abban a sorrendben, amelyben az elektronok pályákra kerülnek, az eribi atom esetében.
- Vannak esetek, amikor egy elektront "fel kell tolni". Ez az az eset, amikor egy pályáról csak egy elektron hiányzik, hogy az elektronok fele vagy az összes része megtalálható legyen, akkor a legközelebbi s vagy p pályáról kell egy elektront venni ahhoz, hogy azt az orbitális pályára vigye, amelyre szüksége van.
- Nem mondhatjuk, hogy az alosztály "energiafrakció-stabilitása" befogadja az elektronok felét. Ez egy túl egyszerűsítés. A "fele az elektronok számának" befogadására képes új alosztály stabil energiaszintjének oka az, hogy mindegyik pályának csak egyetlen elektronja van, így az elektron-elektron taszítás minimálisra csökken.