Szerző:
Clyde Lopez
A Teremtés Dátuma:
26 Július 2021
Frissítés Dátuma:
1 Július 2024
Tartalom
- Lépések
- 1. módszer a 4 -ből: Százalék kiszámítása súly / térfogat képlet segítségével
- 2. módszer a 4 -ből: Molekuláris oldat elkészítése
- 3. módszer a 4 -ből: Ismert koncentrációjú oldatok hígítása
- 4. módszer a 4 -ből: A biztonsági óvintézkedések betartása
- Tippek
- Figyelmeztetések
- Mire van szükséged
Az egyszerű kémiai oldatok könnyen és sokféleképpen elkészíthetők otthon vagy a munkahelyen. Akár por alakú anyagból készít oldatot, akár folyadékot hígít, könnyen meghatározható az egyes komponensek megfelelő mennyisége. A kémiai oldatok elkészítésekor ne felejtse el egyéni védőeszközöket használni a sérülések elkerülése érdekében.
Lépések
1. módszer a 4 -ből: Százalék kiszámítása súly / térfogat képlet segítségével
 1 Definiálja százalék tartalom bekapcsolva súly/ oldat térfogata. A százalékok azt mutatják, hogy egy anyag száz részében hány anyag van. Kémiai oldatoknál ez azt jelenti, hogy ha a koncentráció 1 százalék, akkor 100 milliliter oldat 1 gramm anyagot tartalmaz, azaz 1 ml / 100 ml.
1 Definiálja százalék tartalom bekapcsolva súly/ oldat térfogata. A százalékok azt mutatják, hogy egy anyag száz részében hány anyag van. Kémiai oldatoknál ez azt jelenti, hogy ha a koncentráció 1 százalék, akkor 100 milliliter oldat 1 gramm anyagot tartalmaz, azaz 1 ml / 100 ml. - Például súly szerint: 10 tömeg% -os oldat 10 gramm anyagot tartalmaz 100 ml oldatban oldva.
- Például térfogatban: Egy 23 térfogatszázalékos oldat 23 milliliter folyékony vegyületet tartalmaz 100 ml oldatban.
 2 Határozza meg az elkészíteni kívánt oldat térfogatát. Az anyag szükséges tömegének megállapításához először meg kell határoznia a szükséges oldat végső térfogatát. Ez a mennyiség attól függ, hogy mennyi oldatra van szüksége, milyen gyakran fogja használni, és a kész oldat stabilitásától.
2 Határozza meg az elkészíteni kívánt oldat térfogatát. Az anyag szükséges tömegének megállapításához először meg kell határoznia a szükséges oldat végső térfogatát. Ez a mennyiség attól függ, hogy mennyi oldatra van szüksége, milyen gyakran fogja használni, és a kész oldat stabilitásától. - Ha minden alkalommal friss oldatot kell használnia, akkor csak egy használathoz szükséges mennyiséget készítsen el.
- Ha a megoldás sokáig megőrzi tulajdonságait, akkor nagyobb mennyiséget készíthet elő a későbbi felhasználáshoz.
- Példa: 5% -os NaCl -oldatot kell elkészítenie 500 ml térfogatban.
 3 Számítsa ki az oldat elkészítéséhez szükséges anyag grammszámát. A szükséges grammszám kiszámításához használja a következő képletet: gramm száma = (szükséges százalék) (szükséges térfogat / 100 ml). Ebben az esetben a szükséges százalékokat grammban, a szükséges térfogatot milliliterben fejezik ki.
3 Számítsa ki az oldat elkészítéséhez szükséges anyag grammszámát. A szükséges grammszám kiszámításához használja a következő képletet: gramm száma = (szükséges százalék) (szükséges térfogat / 100 ml). Ebben az esetben a szükséges százalékokat grammban, a szükséges térfogatot milliliterben fejezik ki. - Példa: 5% -os NaCl oldatot kell elkészítenie 500 ml térfogatban.
- grammok száma = (5 g) (500 ml / 100 ml) = 25 gramm.
- Ha NaCl -ot adnak oldatként, akkor a por grammja helyett csak 25 ml NaCl -t kell venni, és ezt a térfogatot kivonni a végső térfogatból: 25 ml NaCl – 475 ml víz.
 4 Mérje le az anyagot. Miután kiszámította az anyag szükséges tömegét, meg kell mérnie ezt a mennyiséget. Vegyen egy kalibrált mérleget, tegyen rá egy tálat, és állítsa be a nullát. Mérje le a szükséges anyagmennyiséget grammokban, és öntse ki.
4 Mérje le az anyagot. Miután kiszámította az anyag szükséges tömegét, meg kell mérnie ezt a mennyiséget. Vegyen egy kalibrált mérleget, tegyen rá egy tálat, és állítsa be a nullát. Mérje le a szükséges anyagmennyiséget grammokban, és öntse ki. - Mielőtt folytatná az oldat elkészítését, feltétlenül tisztítsa meg a mérőedényt a portól.
- A fenti példában 25 gramm NaCl -t kell mérnie.
 5 Oldja fel az anyagot a szükséges mennyiségű folyadékban. Eltérő rendelkezés hiányában oldószerként vizet használnak. Vegyen egy mérőüveget, és mérje ki a szükséges folyadékmennyiséget. Ezután oldja fel a por anyagot a folyadékban.
5 Oldja fel az anyagot a szükséges mennyiségű folyadékban. Eltérő rendelkezés hiányában oldószerként vizet használnak. Vegyen egy mérőüveget, és mérje ki a szükséges folyadékmennyiséget. Ezután oldja fel a por anyagot a folyadékban. - Írja alá a tartályt, amelyben az oldatot tárolja. Világosan tüntesse fel az anyagot és annak koncentrációját.
- Példa: Oldjunk fel 25 gramm NaCl -ot 500 ml vízben, hogy 5% -os oldatot kapjunk.
- Ne feledje, hogy ha folyékony anyagot hígít, a szükséges vízmennyiség eléréséhez vonja le a hozzáadott anyag térfogatát az oldat végső térfogatából: 500 ml - 25 ml = 475 ml víz.
2. módszer a 4 -ből: Molekuláris oldat elkészítése
 1 Határozza meg a felhasznált anyag molekulatömegét a képlet segítségével. A vegyület képletsúlyát (vagy egyszerűen molekulatömegét) gramm per mól (g / mol) -ra írjuk a palack falára. Ha nem találja a palackon a molekulatömeget, keresse meg az interneten.
1 Határozza meg a felhasznált anyag molekulatömegét a képlet segítségével. A vegyület képletsúlyát (vagy egyszerűen molekulatömegét) gramm per mól (g / mol) -ra írjuk a palack falára. Ha nem találja a palackon a molekulatömeget, keresse meg az interneten. - Az anyag molekulatömege az anyag egy móljának tömege (grammban).
- Példa: A nátrium -klorid (NaCl) molekulatömege 58,44 g / mol.
 2 Határozza meg a szükséges oldat térfogatát literben. Egy liter oldat elkészítése nagyon egyszerű, mivel molaritása mól / literben van kifejezve, azonban az oldat céljától függően szükség lehet több vagy kevesebb liter elkészítésére. A végső térfogat segítségével számítsa ki a szükséges grammszámot.
2 Határozza meg a szükséges oldat térfogatát literben. Egy liter oldat elkészítése nagyon egyszerű, mivel molaritása mól / literben van kifejezve, azonban az oldat céljától függően szükség lehet több vagy kevesebb liter elkészítésére. A végső térfogat segítségével számítsa ki a szükséges grammszámot. - Példa: 50 ml 0,75 mólos NaCl -os oldatot kell elkészíteni.
- A milliliter literekké alakításához ossza el 1000 -el, és kapjon 0,05 litert.
 3 Számítsa ki a szükséges molekuláris oldat elkészítéséhez szükséges grammszámot. Ehhez használja a következő képletet: grammok száma = (szükséges térfogat) (szükséges molaritás) (molekulatömeg a képlet szerint). Ne feledje, hogy a szükséges térfogat literben van megadva, a molaritás mol / liter, és a képlet szerinti molekulatömeg gramm / mól.
3 Számítsa ki a szükséges molekuláris oldat elkészítéséhez szükséges grammszámot. Ehhez használja a következő képletet: grammok száma = (szükséges térfogat) (szükséges molaritás) (molekulatömeg a képlet szerint). Ne feledje, hogy a szükséges térfogat literben van megadva, a molaritás mol / liter, és a képlet szerinti molekulatömeg gramm / mól. - Példa: ha 50 ml oldatot kíván készíteni 0,75 mol / 1 NaCl (molekulatömeg a képlet szerint: 58,44 g / mol) frakcióval, akkor számolja ki a NaCl gramm számát.
- grammszám = 0,05 l * 0,75 mol / l * 58,44 g / mol = 2,19 gramm NaCl.
- A mértékegységek csökkentésével gramm anyagot kap.
 4 Mérje le az anyagot. Mérje ki a szükséges mennyiséget megfelelően kalibrált mérleggel. Mérés előtt tegyen egy edényt a mérlegre és nullára. Add hozzá az anyagot a tálba, amíg el nem éri a kívánt tömeget.
4 Mérje le az anyagot. Mérje ki a szükséges mennyiséget megfelelően kalibrált mérleggel. Mérés előtt tegyen egy edényt a mérlegre és nullára. Add hozzá az anyagot a tálba, amíg el nem éri a kívánt tömeget. - Használat után tisztítsa meg a mérőedényt.
- Példa: Mérjünk 2,19 gramm NaCl -ot.
 5 A port fel kell oldani a szükséges mennyiségű folyadékban. Eltérő rendelkezés hiányában a legtöbb megoldás vizet használ. Ebben az esetben ugyanazt a folyadékmennyiséget veszik fel, amelyet az anyag tömegének kiszámításához használtak. Adjunk hozzá anyagot a vízhez és keverjük, amíg teljesen fel nem oldódik.
5 A port fel kell oldani a szükséges mennyiségű folyadékban. Eltérő rendelkezés hiányában a legtöbb megoldás vizet használ. Ebben az esetben ugyanazt a folyadékmennyiséget veszik fel, amelyet az anyag tömegének kiszámításához használtak. Adjunk hozzá anyagot a vízhez és keverjük, amíg teljesen fel nem oldódik. - Írja alá a tartályt az oldattal. Világosan jelölje meg az oldott anyagot és a molaritást, hogy később is használhassa.
- Példa: Főzőpohárral (térfogatmérő műszer) mérjünk ki 50 ml vizet, és oldjunk fel benne 2,19 gramm NaCl -ot.
- Az oldatot addig keverjük, amíg a por teljesen fel nem oldódik.
3. módszer a 4 -ből: Ismert koncentrációjú oldatok hígítása
 1 Határozza meg az egyes oldatok koncentrációját. Az oldatok hígításakor ismernie kell az eredeti oldat és a kívánt oldat koncentrációját.Ez a módszer alkalmas koncentrált oldatok hígítására.
1 Határozza meg az egyes oldatok koncentrációját. Az oldatok hígításakor ismernie kell az eredeti oldat és a kívánt oldat koncentrációját.Ez a módszer alkalmas koncentrált oldatok hígítására. - Példa: Készítsen 75 ml 1,5 M NaCl -oldatot 5 M -os oldatból. A törzsoldat 5 M koncentrációjú, és 1,5 M koncentrációra kell hígítani.
 2 Határozza meg a végső oldat térfogatát. Meg kell találni a fogadni kívánt megoldás térfogatát. Ki kell számítania az oldat mennyiségét, amely szükséges ahhoz, hogy ezt az oldatot a kívánt koncentrációra és térfogatra hígítsa.
2 Határozza meg a végső oldat térfogatát. Meg kell találni a fogadni kívánt megoldás térfogatát. Ki kell számítania az oldat mennyiségét, amely szükséges ahhoz, hogy ezt az oldatot a kívánt koncentrációra és térfogatra hígítsa. - Példa: Készítsen 75 ml 1,5 M NaCl oldatot a kezdeti 5 M oldatból Ebben a példában a végső oldat térfogata 75 ml.
 3 Számítsa ki a kiindulási oldat hígításához szükséges oldat térfogatát. Ehhez a következő képletre van szüksége: V1C1= V2C2ahol V.1 - a kívánt oldat térfogata, C1 - koncentrációja, V2 - a végső oldat térfogata, C2 - koncentrációja.
3 Számítsa ki a kiindulási oldat hígításához szükséges oldat térfogatát. Ehhez a következő képletre van szüksége: V1C1= V2C2ahol V.1 - a kívánt oldat térfogata, C1 - koncentrációja, V2 - a végső oldat térfogata, C2 - koncentrációja. - A szükséges folyadék térfogatának kiszámításához újra kell írni az egyenlőséget V vonatkozásában1: V.1 = (V.2C2) / C1.
- Példa: 75 ml 1,5 M koncentrációjú NaCl -oldatot kell elkészítenie 5 M koncentrációjú oldatból.
- V1 = (V.2C2) / C1 = (0,075 l * 1,5 M) / 5M = 0,0225 l.
- Alakítsa át a litereket milliliterre 1000 -gyel megszorozva, hogy 22,5 ml -t kapjon.
 4 Vonja le az eredeti oldat térfogatát a tervezett végső térfogatból. Az oldat hígításának eredményeképpen rögzített végső térfogatra van szükség. A hígítóoldat térfogatának meghatározásához vonja le a törzsoldat térfogatát a végső térfogatból.
4 Vonja le az eredeti oldat térfogatát a tervezett végső térfogatból. Az oldat hígításának eredményeképpen rögzített végső térfogatra van szükség. A hígítóoldat térfogatának meghatározásához vonja le a törzsoldat térfogatát a végső térfogatból. - Példa: A végső térfogat 75 milliliter, az eredeti térfogat pedig 22,5 milliliter. Így 75 - 22,5 = 52,5 millilitet kapunk. Erre a folyadékmennyiségre lesz szükség az oldat hígításához.
 5 Keverje össze a törzsoldat számított mennyiségét a hígító folyadékkal. Egy főzőpohárral (a folyadék térfogatának mérésére szolgáló műszer) mérje ki a törzsoldat szükséges mennyiségét, és keverje össze a kívánt térfogatú hígító folyadékkal.
5 Keverje össze a törzsoldat számított mennyiségét a hígító folyadékkal. Egy főzőpohárral (a folyadék térfogatának mérésére szolgáló műszer) mérje ki a törzsoldat szükséges mennyiségét, és keverje össze a kívánt térfogatú hígító folyadékkal. - Példa: Mérjen ki 22,5 ml 5 M NaCl törzsoldatot, és hígítsa fel 52,5 ml vízzel. Keverje össze az oldatot.
- Írja fel a hígított oldattal ellátott tartályra annak koncentrációját és összetételét: 1,5 M NaCl.
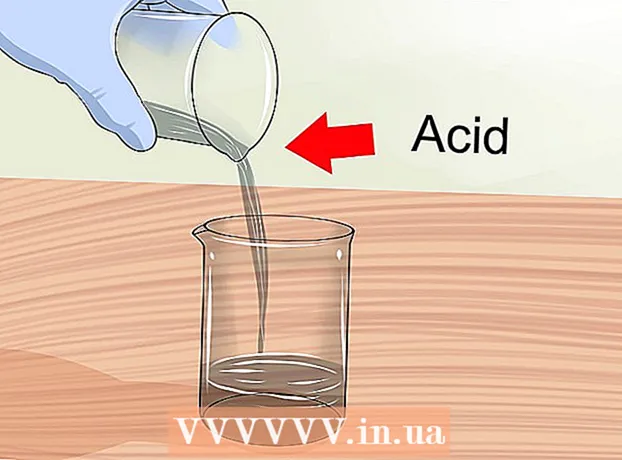
- Ne feledje, ha a savat vízzel hígítja, akkor hozzá kell adnia a vizet, de soha nem fordítva.
4. módszer a 4 -ből: A biztonsági óvintézkedések betartása
 1 Használjon személyi védőfelszerelést. Amikor agresszív vegyszerekkel és oldatokkal dolgozik, védjen azok hatásaitól. Feltétlenül viseljen laboratóriumi kabátot, zárt cipőt, védőszemüveget és kesztyűt.
1 Használjon személyi védőfelszerelést. Amikor agresszív vegyszerekkel és oldatokkal dolgozik, védjen azok hatásaitól. Feltétlenül viseljen laboratóriumi kabátot, zárt cipőt, védőszemüveget és kesztyűt. - Használjon nem éghető anyagból készült laboratóriumi bevonatot.
- A védőszemüvegnek oldalpajzsokkal kell rendelkeznie, amelyek oldalról eltakarják a szemet.
 2 Jól szellőző helyen dolgozzon. Az oldatok keverésekor illékony gázok szabadulhatnak fel. Egyes anyagokat csak laboratóriumi burkolat alatt szabad kezelni. Ha otthon oldatokat kever, nyissa ki az ablakokat, és kapcsolja be a ventilátort, hogy biztosítsa a megfelelő légáramlást.
2 Jól szellőző helyen dolgozzon. Az oldatok keverésekor illékony gázok szabadulhatnak fel. Egyes anyagokat csak laboratóriumi burkolat alatt szabad kezelni. Ha otthon oldatokat kever, nyissa ki az ablakokat, és kapcsolja be a ventilátort, hogy biztosítsa a megfelelő légáramlást.  3 Adjunk hozzá savat a vízhez. Koncentrált savak hígításakor a savat mindig adjuk a vízhez. Amikor a vizet és a savat összekeverik, exoterm (hőleadással járó) reakció lép fel, amely robbanáshoz vezethet, ha vizet adnak a savhoz, és nem fordítva.
3 Adjunk hozzá savat a vízhez. Koncentrált savak hígításakor a savat mindig adjuk a vízhez. Amikor a vizet és a savat összekeverik, exoterm (hőleadással járó) reakció lép fel, amely robbanáshoz vezethet, ha vizet adnak a savhoz, és nem fordítva. - Ne feledje a biztonsági óvintézkedéseket minden alkalommal, amikor savakkal dolgozik.
Tippek
- Mielőtt elkezdené, ismerkedjen meg a témával. A tudás hatalom!
- Próbáljon hagyományos háztartási termékeket használni. Ne próbáljon semmi rendkívüli dolgot tenni. Ha gyanítja, hogy veszély léphet fel, adja fel.
Figyelmeztetések
- Ne keverje össze a fehérítőt és az ammóniát.
- Szükség esetén használjon védőfelszerelést, szemüveget, műanyag kötényt és neoprén kesztyűt.
Mire van szükséged
- Pontos mechanikus vagy elektronikus mérlegek a tömeg meghatározásához. Használhat például konyhai mérleget.
- Fokozott üvegáru. Ezeket az eszközöket megtalálhatja egy konyhai boltban, vagy megrendelheti az interneten. A mérőüveg többféle formában és méretben kapható. A műanyag edények működni fognak, bár nem ellenállnak a magas hőmérsékletnek.