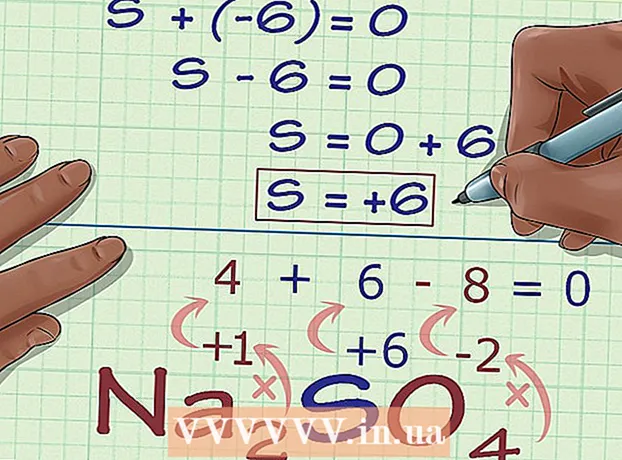
Tartalom
- Lépések
- Rész 1 /2: Az oxidációs állapot meghatározása a kémia törvényei szerint
- 2/2. Rész: Az oxidációs állapot meghatározása a kémia törvényei nélkül
- Tippek
- Mire van szükséged
A kémiában az "oxidáció" és a "redukció" kifejezések olyan reakciókat jelentenek, amelyek során egy atom vagy atomcsoport elektronokat veszít, vagy nyer. Az oxidációs állapot egy vagy több atomhoz rendelt számérték, amely az újraelosztott elektronok számát jellemzi, és azt mutatja, hogy ezek az elektronok hogyan oszlanak el az atomok között a reakció során. Ennek az értéknek az meghatározása egyszerű és meglehetősen összetett eljárás is lehet, az atomoktól és az őket alkotó molekuláktól függően. Ezenkívül egyes elemek atomjai több oxidációs állapotot is tartalmazhatnak. Szerencsére vannak egyszerű, egyértelmű szabályok az oxidációs állapot meghatározására, amelyek magabiztos használatához elegendő a kémia és az algebra alapjainak ismerete.
Lépések
Rész 1 /2: Az oxidációs állapot meghatározása a kémia törvényei szerint
 1 Határozza meg, hogy a szóban forgó anyag elemi -e. A kémiai vegyületen kívüli atomok oxidációs állapota nulla. Ez a szabály mind a különálló szabad atomokból képződő anyagokra, mind azokra, amelyek két elemből állnak, vagy egy elem többatomos molekulái.
1 Határozza meg, hogy a szóban forgó anyag elemi -e. A kémiai vegyületen kívüli atomok oxidációs állapota nulla. Ez a szabály mind a különálló szabad atomokból képződő anyagokra, mind azokra, amelyek két elemből állnak, vagy egy elem többatomos molekulái. - Például Al(ok) és Cl2 oxidációs állapota 0, mivel mindkettő kémiailag nem kötött elemi állapotban van.
- Megjegyezzük, hogy az S kén allotróp formája8, vagy octacera, atipikus szerkezete ellenére is zéró oxidációs állapot jellemzi.
 2 Határozza meg, hogy a szóban forgó anyag ionokból áll -e. Az ionok oxidációs állapota megegyezik töltésükkel. Ez igaz a szabad ionokra és a kémiai vegyületek részét képező ionokra is.
2 Határozza meg, hogy a szóban forgó anyag ionokból áll -e. Az ionok oxidációs állapota megegyezik töltésükkel. Ez igaz a szabad ionokra és a kémiai vegyületek részét képező ionokra is. - Például a Cl -ion oxidációs állapota -1.
- A NaCl kémiai vegyületben a Cl -ion oxidációs állapota is -1. Mivel a Na -ion definíció szerint töltése +1, arra a következtetésre jutunk, hogy a Cl -ion töltése -1, és így oxidációs állapota -1.
 3 Kérjük, vegye figyelembe, hogy a fémionoknak több oxidációs állapota is lehet. Sok fémes elem atomja különböző mennyiségű ionizációra képes. Például egy fém, például vas (Fe) ion töltése +2 vagy +3. A fémionok töltését (és oxidációs állapotukat) más elemek ionjainak töltéseivel lehet meghatározni, amelyekkel ez a fém egy kémiai vegyület része; a szövegben ezt a töltést római számok jelölik: például a vas (III) oxidációs állapota +3.
3 Kérjük, vegye figyelembe, hogy a fémionoknak több oxidációs állapota is lehet. Sok fémes elem atomja különböző mennyiségű ionizációra képes. Például egy fém, például vas (Fe) ion töltése +2 vagy +3. A fémionok töltését (és oxidációs állapotukat) más elemek ionjainak töltéseivel lehet meghatározni, amelyekkel ez a fém egy kémiai vegyület része; a szövegben ezt a töltést római számok jelölik: például a vas (III) oxidációs állapota +3. - Példaként tekintsünk egy alumínium -iont tartalmazó vegyületet. Az AlCl vegyület teljes töltése3 nulla.Mivel tudjuk, hogy a Cl -ionok töltése -1, és a vegyület 3 ilyen iont tartalmaz, a szóban forgó anyag általános semlegessége érdekében az Al -ion töltésének +3 -nak kell lennie. Így ebben az esetben az alumínium oxidációs állapota +3.
 4 Az oxigén oxidációs állapota -2 (néhány kivétellel). Szinte minden esetben az oxigénatomok oxidációs állapota -2. E szabály alól több kivétel is van:
4 Az oxigén oxidációs állapota -2 (néhány kivétellel). Szinte minden esetben az oxigénatomok oxidációs állapota -2. E szabály alól több kivétel is van: - Ha az oxigén elemi állapotban van (O2), oxidációs állapota 0, mint más elemi anyagok esetében.
- Ha az oxigén része peroxid, oxidációs állapota -1. A peroxidok olyan vegyületek csoportja, amelyek egyszerű oxigén-oxigén kötést tartalmaznak (azaz O peroxid anion2). Például a H összetételében2O2 (hidrogén -peroxid) oxigén töltési és oxidációs állapota -1.
- Fluorral kombinálva az oxigén oxidációs állapota +2, olvassa el az alábbi fluorra vonatkozó szabályt.
 5 A hidrogén oxidációs állapota +1, néhány kivételtől eltekintve. Az oxigénhez hasonlóan vannak kivételek is. Általában a hidrogén oxidációs állapota +1 (ha nem H elemi állapotban van2). A hidrideknek nevezett vegyületekben azonban a hidrogén oxidációs állapota -1.
5 A hidrogén oxidációs állapota +1, néhány kivételtől eltekintve. Az oxigénhez hasonlóan vannak kivételek is. Általában a hidrogén oxidációs állapota +1 (ha nem H elemi állapotban van2). A hidrideknek nevezett vegyületekben azonban a hidrogén oxidációs állapota -1. - Például H -ban2O A hidrogén oxidációs állapota +1, mert az oxigénatom töltése -2, és két +1 töltés szükséges az általános semlegességhez. Ennek ellenére a nátrium -hidrid összetételében a hidrogén oxidációs állapota már -1, mivel a Na -ion töltése +1, és az általános elektroneutralitás szempontjából a hidrogénatom töltésének (és így oxidációs állapotának) legyen -1.
 6 Fluor mindig oxidációs állapota -1. Mint már említettük, egyes elemek (fémionok, oxigénatomok peroxidokban stb.) Oxidációs állapota számos tényezőtől függően változhat. A fluor oxidációs állapota azonban változatlanul -1. Ez annak a ténynek köszönhető, hogy ez az elem rendelkezik a legnagyobb elektronegativitással - más szóval, a fluoratomok a legkevésbé hajlandók elválni saját elektronjaiktól, és a legaktívabban vonzzák az idegen elektronokat. Így töltésük változatlan marad.
6 Fluor mindig oxidációs állapota -1. Mint már említettük, egyes elemek (fémionok, oxigénatomok peroxidokban stb.) Oxidációs állapota számos tényezőtől függően változhat. A fluor oxidációs állapota azonban változatlanul -1. Ez annak a ténynek köszönhető, hogy ez az elem rendelkezik a legnagyobb elektronegativitással - más szóval, a fluoratomok a legkevésbé hajlandók elválni saját elektronjaiktól, és a legaktívabban vonzzák az idegen elektronokat. Így töltésük változatlan marad.  7 Az oxidációs állapotok összege egy vegyületben egyenlő a töltésével. A kémiai vegyületet alkotó összes atom oxidációs állapotának össze kell adnia ennek a vegyületnek a töltését. Például, ha egy vegyület semleges, akkor minden atomjának oxidációs állapotának összege nulla legyen; ha a vegyület poliatomikus ion, amelynek töltése -1, akkor az oxidációs állapotok összege -1, és így tovább.
7 Az oxidációs állapotok összege egy vegyületben egyenlő a töltésével. A kémiai vegyületet alkotó összes atom oxidációs állapotának össze kell adnia ennek a vegyületnek a töltését. Például, ha egy vegyület semleges, akkor minden atomjának oxidációs állapotának összege nulla legyen; ha a vegyület poliatomikus ion, amelynek töltése -1, akkor az oxidációs állapotok összege -1, és így tovább. - Ez egy jó vizsgálati módszer - ha az oxidációs állapotok összege nem egyenlő a vegyület teljes töltésével, akkor valahol téved.
2/2. Rész: Az oxidációs állapot meghatározása a kémia törvényei nélkül
 1 Keresse meg azokat az atomokat, amelyeknek nincsenek szigorú szabályai az oxidációs állapotukra vonatkozóan. Egyes elemek esetében nincsenek szilárdan megállapított szabályok az oxidációs állapot megtalálására. Ha egy atom nem felel meg a fent felsorolt szabályok egyikének, és nem ismeri a töltését (például az atom egy komplex része, és a töltése nincs megadva), akkor meghatározhatja az ilyen atom oxidációs állapotát kizárással. Először határozza meg a vegyület összes többi atomjának töltését, majd a vegyület ismert teljes töltéséből számítsa ki ennek az atomnak az oxidációs állapotát.
1 Keresse meg azokat az atomokat, amelyeknek nincsenek szigorú szabályai az oxidációs állapotukra vonatkozóan. Egyes elemek esetében nincsenek szilárdan megállapított szabályok az oxidációs állapot megtalálására. Ha egy atom nem felel meg a fent felsorolt szabályok egyikének, és nem ismeri a töltését (például az atom egy komplex része, és a töltése nincs megadva), akkor meghatározhatja az ilyen atom oxidációs állapotát kizárással. Először határozza meg a vegyület összes többi atomjának töltését, majd a vegyület ismert teljes töltéséből számítsa ki ennek az atomnak az oxidációs állapotát. - Például a Na vegyületben2ÍGY4 a kénatom (S) töltése ismeretlen - csak annyit tudunk, hogy nem nulla, mivel a kén nincs elemi állapotban. Ez a vegyület jó példa arra, hogy szemléltesse az oxidációs állapot meghatározására szolgáló algebrai módszert.
 2 Keresse meg a vegyület többi elemének oxidációs állapotát. A fent leírt szabályok alkalmazásával határozza meg a vegyület többi atomjának oxidációs állapotát. Ne felejtsük el a szabály kivételeit az O, H és így tovább.
2 Keresse meg a vegyület többi elemének oxidációs állapotát. A fent leírt szabályok alkalmazásával határozza meg a vegyület többi atomjának oxidációs állapotát. Ne felejtsük el a szabály kivételeit az O, H és így tovább. - Na számára2ÍGY4, szabályainkat használva megállapítjuk, hogy a Na -ion töltése (és ezáltal az oxidációs állapota) +1, és mindegyik oxigénatomra -2.
 3 Szorozzuk meg az atomok számát oxidációs állapotukkal. Most, hogy ismerjük az egy kivételével az összes atom oxidációs állapotát, figyelembe kell venni, hogy egyes elemekből több atom is lehet. Szorozzuk meg az egyes elemek atomjainak számát (ezt a vegyület kémiai képletében az elem szimbólumát követő indexként jelezzük) az oxidációs állapotával.
3 Szorozzuk meg az atomok számát oxidációs állapotukkal. Most, hogy ismerjük az egy kivételével az összes atom oxidációs állapotát, figyelembe kell venni, hogy egyes elemekből több atom is lehet. Szorozzuk meg az egyes elemek atomjainak számát (ezt a vegyület kémiai képletében az elem szimbólumát követő indexként jelezzük) az oxidációs állapotával. - Na2ÍGY4 2 Na- és 4 O -atomunk van. Így 2 × +1 -gyel megszorozva megkapjuk az összes Na -atom oxidációs állapotát (2), és megszorozzuk 4 × -2 -t -az O (-8) atomok oxidációs állapotát.
 4 Add össze a korábbi eredményeket. A szorzás eredményeit összegezve megkapjuk a vegyület oxidációs állapotát nélkül figyelembe véve a kívánt atom hozzájárulását.
4 Add össze a korábbi eredményeket. A szorzás eredményeit összegezve megkapjuk a vegyület oxidációs állapotát nélkül figyelembe véve a kívánt atom hozzájárulását. - Példánkban Na2ÍGY4 összeadunk 2 és -8 és kapunk -6.
 5 Keresse meg az ismeretlen oxidációs állapotot a vegyület töltéséből. Most már minden adata megvan a kívánt oxidációs állapot egyszerű kiszámításához. Írjon fel egy egyenletet, amelynek bal oldalán lesz az előző számítási lépésben kapott szám és az ismeretlen oxidációs állapot összege, valamint a vegyület teljes töltésének jobb oldalán. Más szavakkal, (Az ismert oxidációs állapotok összege) + (kívánt oxidációs állapot) = (egy vegyület töltése).
5 Keresse meg az ismeretlen oxidációs állapotot a vegyület töltéséből. Most már minden adata megvan a kívánt oxidációs állapot egyszerű kiszámításához. Írjon fel egy egyenletet, amelynek bal oldalán lesz az előző számítási lépésben kapott szám és az ismeretlen oxidációs állapot összege, valamint a vegyület teljes töltésének jobb oldalán. Más szavakkal, (Az ismert oxidációs állapotok összege) + (kívánt oxidációs állapot) = (egy vegyület töltése).- Esetünkben Na2ÍGY4 a megoldás így néz ki:
- (Az ismert oxidációs állapotok összege) + (kívánt oxidációs állapot) = (összetett töltés)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2ÍGY4 a kén oxidációs állapotú 6.
- Esetünkben Na2ÍGY4 a megoldás így néz ki:
Tippek
- A vegyületekben az összes oxidációs állapot összegének meg kell egyeznie a töltéssel. Például, ha a vegyület kétatomos ion, akkor az atomok oxidációs állapotának összegének meg kell egyeznie a teljes ionos töltéssel.
- Nagyon hasznos lehet használni a periódusos rendszert, és tudni, hogy hol találhatók benne a fémes és nem fémes elemek.
- Az atomok oxidációs állapota elemi formában mindig nulla. Egyetlen ion oxidációs állapota egyenlő a töltésével. A periódusos rendszer 1A csoportjának elemei, mint például a hidrogén, a lítium, a nátrium, elemi formában +1 oxidációs állapotúak; A 2A csoportba tartozó fémek, például magnézium és kalcium oxidációs állapota elemi formában +2. Az oxigénnek és a hidrogénnek a kémiai kötés típusától függően 2 különböző oxidációs állapota lehet.
Mire van szükséged
- Az elemek időszakos táblázata
- Internet -hozzáférés vagy kémia referenciakönyvek
- Egy papírlap, toll vagy ceruza
- Számológép