Szerző:
Joan Hall
A Teremtés Dátuma:
28 Február 2021
Frissítés Dátuma:
1 Július 2024
Tartalom
- Lépések
- 1. módszer a 3 -ból: Atomtömeg keresése az elemek periódusos rendszerével
- 2. módszer a 3 -ból: Egyetlen atom atomtömegének kiszámítása
- 3. módszer 3 -ból: Egy elem relatív atomtömegének (atomtömegének) kiszámítása
- Tippek
- Mire van szükséged
Atomtömeg az összes proton, neutron és elektron tömegének összege, amely ezt vagy azt az atomot vagy molekulát alkotja. A protonokhoz és a neutronokhoz képest az elektronok tömege nagyon kicsi, ezért nem veszik figyelembe a számítások során. Bár ez formai szempontból helytelen, ezt a kifejezést gyakran használják az elem összes izotópjának átlagos atomtömegére való utalásra. Valójában ez a relatív atomtömeg, más néven atomtömeg elem. Az atomtömeg az elem összes természetben előforduló izotópjának atomtömegének átlaga. A vegyészeknek munkájuk során meg kell különböztetniük ezt a kétféle atomtömeget - a helytelen atomtömeg -érték például hibás eredményhez vezethet a reakciótermék hozama szempontjából.
Lépések
1. módszer a 3 -ból: Atomtömeg keresése az elemek periódusos rendszerével
 1 Ismerje meg az atomtömeg írásának módját. Az atomtömeget, vagyis egy adott atom vagy molekula tömegét standard SI -egységekben - grammban, kilogrammban stb. - lehet kifejezni. Mivel azonban ezekben az egységekben kifejezett atomtömegek rendkívül kicsik, gyakran egyesített atomtömegegységekben vagy rövidített amu -ban rögzítik őket. - atomtömegegységek. Egy atomtömegegység a szén-12 standard izotóp tömegének 1/12-e.
1 Ismerje meg az atomtömeg írásának módját. Az atomtömeget, vagyis egy adott atom vagy molekula tömegét standard SI -egységekben - grammban, kilogrammban stb. - lehet kifejezni. Mivel azonban ezekben az egységekben kifejezett atomtömegek rendkívül kicsik, gyakran egyesített atomtömegegységekben vagy rövidített amu -ban rögzítik őket. - atomtömegegységek. Egy atomtömegegység a szén-12 standard izotóp tömegének 1/12-e. - Az atomtömegegység jellemzi a tömeget egy mól adott elem grammban... Ez az érték nagyon hasznos a gyakorlati számítások során, mivel felhasználható az adott anyag adott számú atomjának vagy molekulájának tömegének egyszerű átalakítására mollra, és fordítva.
 2 Keresse meg az atomtömeget a periódusos rendszerben. A legtöbb szabványos periodikus táblázat tartalmazza az egyes elemek atomtömegeit (atomsúlyokat). Általában számként jelennek meg a cella alján az elem mellett, a kémiai elemet jelölő betűk alatt. Ez általában nem egész szám, hanem tizedes tört.
2 Keresse meg az atomtömeget a periódusos rendszerben. A legtöbb szabványos periodikus táblázat tartalmazza az egyes elemek atomtömegeit (atomsúlyokat). Általában számként jelennek meg a cella alján az elem mellett, a kémiai elemet jelölő betűk alatt. Ez általában nem egész szám, hanem tizedes tört. - Vegye figyelembe, hogy a periódusos rendszerben az egyes elemekhez megadott összes relatív atomtömeg az átlagos értékeket. A kémiai elemek különbözőek izotópok - vegyi anyagok, amelyek tömege eltérő, mert az atommagban további vagy hiányzó neutronok vannak. Ezért a periódusos rendszerben felsorolt relatív atomtömegek átlagként használhatók egy adott elem atomjaira, de nem mint egy adott elem egyik atomjának tömege.
- A periódusos rendszerben megadott relatív atomtömegek az atomok és molekulák moláris tömegének kiszámítására szolgálnak. Atomtömegek amu -ban kifejezve (mint a periódusos rendszerben) lényegében dimenzió nélküli. Ha azonban egyszerűen megszorozzuk az atomtömeget 1 g / mol -tal, akkor egy elem hasznos jellemzőjét kapjuk - az elem egy móljának tömegét (grammban).
 3 Ne feledje, hogy a periódusos rendszer felsorolja az elemek átlagos atomtömegeit. Amint azt korábban említettük, a periódusos rendszerben az egyes elemeknél feltüntetett relatív atomtömegek az atom összes izotópjának tömegének átlaga. Ez az átlag sok gyakorlati célra értékes: például a több atomból álló molekulák moláris tömegének kiszámítására szolgál. Ha azonban egyes atomokkal van dolga, ez az érték általában nem elegendő.
3 Ne feledje, hogy a periódusos rendszer felsorolja az elemek átlagos atomtömegeit. Amint azt korábban említettük, a periódusos rendszerben az egyes elemeknél feltüntetett relatív atomtömegek az atom összes izotópjának tömegének átlaga. Ez az átlag sok gyakorlati célra értékes: például a több atomból álló molekulák moláris tömegének kiszámítására szolgál. Ha azonban egyes atomokkal van dolga, ez az érték általában nem elegendő. - Mivel az átlagos atomtömeg több izotóp átlagos értéke, a periódusos rendszerben megadott érték nem pontos bármelyik atom atomtömegének értéke.
- Az egyes atomok atomtömegét az egyetlen atomban lévő protonok és neutronok pontos számának figyelembevételével kell kiszámítani.
2. módszer a 3 -ból: Egyetlen atom atomtömegének kiszámítása
 1 Keresse meg az adott elem atomszámát vagy izotópját. Az atomszám a protonok száma egy elem atomjaiban, soha nem változik. Például minden hidrogénatom, és csak egy protonjuk van. A nátrium atomszáma 11, mert magja tizenegy proton, míg az oxigén atomszáma nyolc, mivel a magja nyolc proton. Bármely elem atomszámát megtalálhatja Mendelejev periódusos rendszerében - szinte minden szabványos verziójában ez a szám a kémiai elem betűjelzése felett van feltüntetve. Az atomszám mindig pozitív egész szám.
1 Keresse meg az adott elem atomszámát vagy izotópját. Az atomszám a protonok száma egy elem atomjaiban, soha nem változik. Például minden hidrogénatom, és csak egy protonjuk van. A nátrium atomszáma 11, mert magja tizenegy proton, míg az oxigén atomszáma nyolc, mivel a magja nyolc proton. Bármely elem atomszámát megtalálhatja Mendelejev periódusos rendszerében - szinte minden szabványos verziójában ez a szám a kémiai elem betűjelzése felett van feltüntetve. Az atomszám mindig pozitív egész szám. - Tegyük fel, hogy egy szénatomra vagyunk kíváncsiak. A szénatomokban mindig hat proton található, így tudjuk, hogy atomszáma 6. Ezen kívül azt látjuk, hogy a periódusos rendszerben a cella (C) felső részében a "6" szám látható, hogy az atom szénszáma hat.
- Vegye figyelembe, hogy egy elem atomszáma nem egyedileg kapcsolódik a periódusos rendszer relatív atomtömegéhez. Bár különösen a táblázat tetején lévő elemek esetében úgy tűnhet, hogy egy elem atomtömege kétszerese az atomszámának, soha nem számítjuk ki úgy, hogy megszorozzuk az atomszámot kettővel.
 2 Keresse meg a neutronok számát a magban. A neutronok száma eltérő lehet ugyanazon elem különböző atomjainál. Ha ugyanazon elem két atomjának azonos számú protonja különböző számú neutronnal rendelkezik, akkor ezek az elem különböző izotópjai.Ellentétben a protonok számával, amely soha nem változik, az adott elem atomjaiban lévő neutronok száma gyakran változhat, így egy elem átlagos atomtömege tizedes törtként van írva, értéke két szomszédos egész szám között van.
2 Keresse meg a neutronok számát a magban. A neutronok száma eltérő lehet ugyanazon elem különböző atomjainál. Ha ugyanazon elem két atomjának azonos számú protonja különböző számú neutronnal rendelkezik, akkor ezek az elem különböző izotópjai.Ellentétben a protonok számával, amely soha nem változik, az adott elem atomjaiban lévő neutronok száma gyakran változhat, így egy elem átlagos atomtömege tizedes törtként van írva, értéke két szomszédos egész szám között van. - A neutronok számát az elem izotópjának kijelölésével lehet meghatározni. Például a szén-14 a szén-12 természetben előforduló radioaktív izotópja. Gyakran az izotópszámot felső indexszámként tüntetik fel az elem szimbóluma előtt: C. A neutronok számát úgy találjuk meg, hogy kivonjuk a protonok számát az izotópszámból: 14 - 6 = 8 neutron.
- Tegyük fel, hogy az érdekelt szénatom hat neutronnal rendelkezik (C). Ez a szén leggyakoribb izotópja, amely ennek az elemnek az összes atomjának mintegy 99% -át teszi ki. A szénatomok körülbelül 1% -a azonban 7 neutronnal rendelkezik (C). Más típusú szénatomok több mint 7 vagy kevesebb mint 6 neutront tartalmaznak, és nagyon kis mennyiségben léteznek.
 3 Összeadjuk a protonok és neutronok számát. Ez lesz az adott atom atomtömege. Figyelmen kívül hagyja a magot körülvevő elektronok számát - össztömegük rendkívül kicsi, így gyakorlatilag nem befolyásolják a számításokat.
3 Összeadjuk a protonok és neutronok számát. Ez lesz az adott atom atomtömege. Figyelmen kívül hagyja a magot körülvevő elektronok számát - össztömegük rendkívül kicsi, így gyakorlatilag nem befolyásolják a számításokat. - Szénatomunkban 6 proton + 6 neutron = 12. Így ennek a szénatomnak az atomtömege 12. Ha ez lenne a "szén-13" izotóp, akkor tudnánk, hogy 6 proton + 7 neutron = atomtömeg 13.
- Valójában a szén-13 atomtömege 13,003355, és ez az érték pontosabb, mivel kísérletileg határozták meg.
- Az atomtömeg nagyon közel van az izotópszámhoz. A számítások megkönnyítése érdekében gyakran feltételezik, hogy az izotópszám megegyezik az atomtömeggel. Az atomtömeg kísérletileg meghatározott értékei kissé meghaladják az izotópszámot az elektronok igen kis hozzájárulása miatt.
3. módszer 3 -ból: Egy elem relatív atomtömegének (atomtömegének) kiszámítása
 1 Határozza meg, hogy mely izotópok vannak a mintában. A vegyészek gyakran meghatározzák az izotópok arányát egy adott mintában egy speciális műszerrel, az úgynevezett tömegspektrométerrel. A képzés során azonban ezeket az adatokat a feladatok, az ellenőrzés feltételei és így tovább a tudományos szakirodalomból vett értékek formájában kapjuk meg.
1 Határozza meg, hogy mely izotópok vannak a mintában. A vegyészek gyakran meghatározzák az izotópok arányát egy adott mintában egy speciális műszerrel, az úgynevezett tömegspektrométerrel. A képzés során azonban ezeket az adatokat a feladatok, az ellenőrzés feltételei és így tovább a tudományos szakirodalomból vett értékek formájában kapjuk meg. - Esetünkben tegyük fel, hogy két izotóppal van dolgunk: szén-12 és szén-13.
 2 Határozza meg a minta egyes izotópjainak relatív tartalmát. Minden elemnél különböző izotópok fordulnak elő különböző arányokban. Ezeket az arányokat szinte mindig százalékban fejezik ki. Néhány izotóp nagyon gyakori, míg mások nagyon ritkák - olykor olyan nehezen észlelhetők. Ezek a mennyiségek meghatározhatók tömegspektrometriával, vagy megtalálhatók egy kézikönyvben.
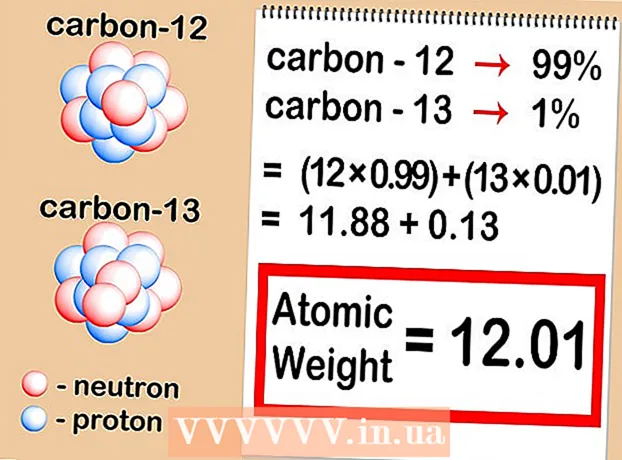
2 Határozza meg a minta egyes izotópjainak relatív tartalmát. Minden elemnél különböző izotópok fordulnak elő különböző arányokban. Ezeket az arányokat szinte mindig százalékban fejezik ki. Néhány izotóp nagyon gyakori, míg mások nagyon ritkák - olykor olyan nehezen észlelhetők. Ezek a mennyiségek meghatározhatók tömegspektrometriával, vagy megtalálhatók egy kézikönyvben. - Tegyük fel, hogy a szén-12 koncentrációja 99%, a szén-13 pedig 1%. A szén egyéb izotópjai igazán léteznek, de olyan kis mennyiségben, hogy ebben az esetben elhanyagolhatók.
 3 Szorozzuk meg az egyes izotópok atomtömegét a minta koncentrációjával. Minden izotóp atomtömegét megszorozzuk százalékával (tizedes törtként kifejezve). A százalékok tizedesjegyekké alakításához egyszerűen ossza el 100 -zal. A kapott koncentrációnak mindig 1 -nek kell lennie.
3 Szorozzuk meg az egyes izotópok atomtömegét a minta koncentrációjával. Minden izotóp atomtömegét megszorozzuk százalékával (tizedes törtként kifejezve). A százalékok tizedesjegyekké alakításához egyszerűen ossza el 100 -zal. A kapott koncentrációnak mindig 1 -nek kell lennie. - A mintánk szén-12 és szén-13-at tartalmaz. Ha a szén-12 a minta 99% -a, a szén-13 pedig 1%, akkor meg kell szorozni a 12-et (a szén-12 atomtömege) 0,99-gyel és a 13-at (a szén-13 atomtömege) 0,01-gyel.
- A referenciakönyvek százalékokat adnak meg egy elem összes izotópjának ismert mennyisége alapján. A legtöbb kémia tankönyv ezeket az információkat táblázatos formában tartalmazza a könyv végén. A vizsgált minta esetében az izotópok relatív koncentrációját tömegspektrométerrel is meg lehet határozni.
 4 Adja össze az eredményeket. Foglalja össze az előző lépésben kapott szorzási eredményeket.E művelet eredményeként megtalálja az elem relatív atomtömegét - a szóban forgó elem izotópjainak atomtömegének átlagos értékét. Ha egy elem egészét vesszük figyelembe, nem pedig egy adott elem konkrét izotópját, akkor ezt az értéket használjuk.
4 Adja össze az eredményeket. Foglalja össze az előző lépésben kapott szorzási eredményeket.E művelet eredményeként megtalálja az elem relatív atomtömegét - a szóban forgó elem izotópjainak atomtömegének átlagos értékét. Ha egy elem egészét vesszük figyelembe, nem pedig egy adott elem konkrét izotópját, akkor ezt az értéket használjuk. - Példánkban 12 x 0,99 = 11,88 a szén-12 és 13 x 0,01 = 0,13 a szén-13 esetében. A relatív atomtömeg esetünkben 11,88 + 0,13 = 12,01.
Tippek
- Egyes izotópok kevésbé stabilak, mint mások: a magban kevesebb protont és neutront tartalmazó elemek atomjaivá bomlanak, és az atommagot alkotó részecskéket szabadítanak fel. Az ilyen izotópokat radioaktívnak nevezik.
Mire van szükséged
- Kémia kézikönyv
- Számológép