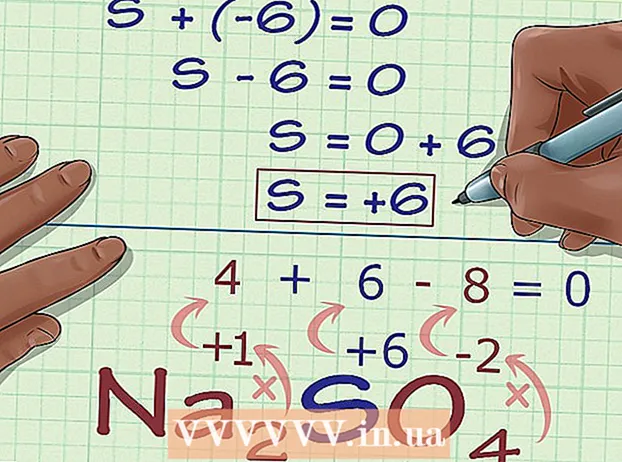
Tartalom
- Lépni
- 1. rész: 2: Oxidációs számok hozzárendelése kémiai szabályok alapján
- 2. rész: Számok hozzárendelése atomokhoz az oxidációs számok szabályai nélkül
- Tippek
- Szükségletek
A kémiában az "oxidáció" és a "redukció" kifejezések azokat a reakciókat jelentik, amelyekben egy atom (vagy atomcsoport) elektronokat veszít vagy nyer. Az oxidációs számok az atomokhoz (vagy atomcsoportokhoz) rendelt számok, amelyek segítik a vegyészeket abban, hogy szabályozzák, hány elektron áll rendelkezésre a kiszorításhoz, és hogy az adott reaktánsok oxidálódnak-e vagy redukálódnak-e egy reakció során. Az oxidációs számok atomokhoz rendelésének folyamata nagyon egyszerűtől a bonyolultabbig terjedhet, az atomok töltésétől és a molekulák kémiai összetételétől függően, amelyeknek részei. A dolgok bonyolultabbá tétele érdekében egyes atomoknak több oxidációs száma is lehet. Szerencsére az oxidációs számok hozzárendelését világosan meghatározott, könnyen követhető szabályok szabályozzák, de a kémia és az algebra alapvető ismerete sokkal könnyebbé teszi ezeket a szabályokat.
Lépni
1. rész: 2: Oxidációs számok hozzárendelése kémiai szabályok alapján
 Határozza meg, hogy a kérdéses anyag elemi-e. A szabad, megkötetlen atomok oxidációs száma mindig 0. Ez igaz mind az egyetlen atomból álló atomokra, mind azokra az atomokra, amelyek elemi formája diatóma vagy többatomi.
Határozza meg, hogy a kérdéses anyag elemi-e. A szabad, megkötetlen atomok oxidációs száma mindig 0. Ez igaz mind az egyetlen atomból álló atomokra, mind azokra az atomokra, amelyek elemi formája diatóma vagy többatomi. - Például Als és Cl2 mindkettő oxidációs száma 0, mert nem összetett atomok.
- Vegye figyelembe, hogy a kén elemi formájában, az S8 (oktaszulfur), bár szabálytalan, oxidációs száma szintén 0.
 Határozza meg, hogy a kérdéses anyag ion-e. Az ionok oxidációs száma megegyezik a töltésükkel. Ez vonatkozik a meg nem kötött ionokra, valamint azokra az ionokra, amelyek egy összetett ion részét képezik.
Határozza meg, hogy a kérdéses anyag ion-e. Az ionok oxidációs száma megegyezik a töltésükkel. Ez vonatkozik a meg nem kötött ionokra, valamint azokra az ionokra, amelyek egy összetett ion részét képezik. - Például a Cl ion oxidációs száma -1.
- A Cl ion még van oxidációs száma -1, ha a NaCl vegyület része. Mivel a Na-ion definíció szerint +1 töltéssel rendelkezik, tudjuk, hogy a Cl-ion töltése -1, így az oxidációs szám továbbra is -1.
 A fémionok esetében jó megjegyezni, hogy többféle oxidációs szám lehetséges. Sok fémnek több leszállása lehet. Például a fémvas (Fe) lehet +2 vagy +3 töltésű ion. a fémionok töltése (és így azok oxidációs száma) meghatározható a többi atom töltésével kapcsolatban, amelynek összetételében vannak, vagy, szövegként írva, a római számokkal történő jelöléssel (például a mondat: "A vas (III) ion töltése +3.").
A fémionok esetében jó megjegyezni, hogy többféle oxidációs szám lehetséges. Sok fémnek több leszállása lehet. Például a fémvas (Fe) lehet +2 vagy +3 töltésű ion. a fémionok töltése (és így azok oxidációs száma) meghatározható a többi atom töltésével kapcsolatban, amelynek összetételében vannak, vagy, szövegként írva, a római számokkal történő jelöléssel (például a mondat: "A vas (III) ion töltése +3."). - Vizsgáljuk meg például egy alumíniumiont tartalmazó vegyületet. Az AlCl vegyület3 töltése 0. Mivel tudjuk, hogy Cl-ionok töltése -1 és 3 Cl-ionok vannak jelen a vegyületben, az Al-ion töltésének +3-nak kell lennie, így az összes összeadott ion töltése 0. Tehát az Al oxidációs száma +3.
 Rendeljen oxigénhez oxidációs számot -2 (kivéve). Ban ben majdnem az oxigénatomok oxidációs száma minden esetben -2. Néhány kivétel van ez alól a szabály alól:
Rendeljen oxigénhez oxidációs számot -2 (kivéve). Ban ben majdnem az oxigénatomok oxidációs száma minden esetben -2. Néhány kivétel van ez alól a szabály alól: - Ha az oxigén elemi állapotban van (O2), akkor az oxidációs szám megegyezik 0-val, ami minden elemi atom esetében érvényes.
- Amikor az oxigén része peroxid, akkor az oxidációs szám -1. A peroxidok olyan vegyületek csoportja, amelyek oxigén-oxigén kötéssel rendelkeznek (vagy a peroxid-anion O-val)2). Például a H molekulában2O2 (hidrogén-peroxid), az oxigén oxidációs száma (és töltése) -1. Továbbá, ha az oxigén a szuperoxid része, az oxidációs szám -0,5.
- Ha az oxigén fluorhoz kötődik, az oxidációs szám +2. További információkért lásd az alábbi fluorszabályt. Én nem2F.2) ez +1.
 Rendeljen a hidrogénhez +1 oxidációs számot (kivéve). Az oxigénhez hasonlóan a hidrogén oxidációs száma kivételes esettől függ. Általában a hidrogén oxidációs száma +1 (kivéve a H elemi formát)2). De a hibridek nevű speciális vegyület esetében a hidrogén oxidációs száma -1.
Rendeljen a hidrogénhez +1 oxidációs számot (kivéve). Az oxigénhez hasonlóan a hidrogén oxidációs száma kivételes esettől függ. Általában a hidrogén oxidációs száma +1 (kivéve a H elemi formát)2). De a hibridek nevű speciális vegyület esetében a hidrogén oxidációs száma -1. - Például H-ból2Ó, tudjuk, hogy a hidrogén oxidációs száma +1, mert az oxigén töltése -2, és 2 +1 töltésre van szükségünk ahhoz, hogy vegyületet állítsunk elő, amelynek teljes töltése nulla. De a nátrium-hidrid (NaH) anyagnál a hidrogén oxidációs száma -1, mivel a Na-ion töltése +1, és a 0 vegyület teljes töltésének eléréséhez a hidrogén töltése (és így oxidációs száma) -1.
 Fluor mindig oxidációs száma -1. Amint azt fentebb jeleztük, bizonyos elemek oxidációs száma különböző tényezők (fémionok, oxigénatomok peroxidokban stb.) Miatt változhat. A fluor oxidációs száma viszont -1, és ez soha nem változik. Ennek oka, hogy a fluor a leginkább elektro-negatív elem, vagy más szóval, ez az az elem, amely legkevésbé hajlandó lemondani az elektronokról, és nagy valószínűséggel átveszi az elektronokat más atomoktól. Ezért az oxidációs szám nem változik.
Fluor mindig oxidációs száma -1. Amint azt fentebb jeleztük, bizonyos elemek oxidációs száma különböző tényezők (fémionok, oxigénatomok peroxidokban stb.) Miatt változhat. A fluor oxidációs száma viszont -1, és ez soha nem változik. Ennek oka, hogy a fluor a leginkább elektro-negatív elem, vagy más szóval, ez az az elem, amely legkevésbé hajlandó lemondani az elektronokról, és nagy valószínűséggel átveszi az elektronokat más atomoktól. Ezért az oxidációs szám nem változik.  Egy vegyület oxidációs számai megegyeznek a vegyület töltésével. Egy vegyület összes atomjának oxidációs száma megegyezik az adott vegyület töltésével. Például, ha egy vegyületnek nincs töltése, akkor az összes oxidációs szám összege nulla lesz; ha a vegyület poliatomi ion, amelynek töltése -1, akkor a hozzáadott oxidációs számoknak -1-nek kell lenniük stb.
Egy vegyület oxidációs számai megegyeznek a vegyület töltésével. Egy vegyület összes atomjának oxidációs száma megegyezik az adott vegyület töltésével. Például, ha egy vegyületnek nincs töltése, akkor az összes oxidációs szám összege nulla lesz; ha a vegyület poliatomi ion, amelynek töltése -1, akkor a hozzáadott oxidációs számoknak -1-nek kell lenniük stb. - Ez jó módszer a válasz ellenőrzésére - ha egy vegyület összesített oxidációs száma nem egyenlő az adott vegyület töltésével, akkor tudod, hogy hibáztál.
2. rész: Számok hozzárendelése atomokhoz az oxidációs számok szabályai nélkül
 Keresse meg az atomokat az oxidációs szám szabályai nélkül. Egyes atomok nem tartják be az oxidációs számok megállapításának szabályait. Ha egy atom nem felel meg a fenti szabályoknak, és nem biztos abban, hogy mi a töltése (például, ha egy nagyobb vegyület része, így az egyedi töltés ismeretlen), akkor megtalálja az atom oxidációs számát megszüntetése. Először határozza meg, hogy mi a vegyület minden más atomjának oxidációja. Ezután megoldja az egyenletben az ismeretlen összegét, a vegyület teljes töltése alapján.
Keresse meg az atomokat az oxidációs szám szabályai nélkül. Egyes atomok nem tartják be az oxidációs számok megállapításának szabályait. Ha egy atom nem felel meg a fenti szabályoknak, és nem biztos abban, hogy mi a töltése (például, ha egy nagyobb vegyület része, így az egyedi töltés ismeretlen), akkor megtalálja az atom oxidációs számát megszüntetése. Először határozza meg, hogy mi a vegyület minden más atomjának oxidációja. Ezután megoldja az egyenletben az ismeretlen összegét, a vegyület teljes töltése alapján. - Például a Na vegyületben2ÍGY4, a kén (S) töltése ismeretlen - nem elemi formájában van, tehát nem 0, de csak ennyit tudunk. Ez jó jelölt a módszer alkalmazásához az oxidációs szám algebrai meghatározásához.
 Határozza meg a vegyület többi elemének ismert oxidációs számát! Az oxidációs szám hozzárendelési szabályainak felhasználásával meghatározzuk, hogy a vegyület melyik atomjának hány oxidációs száma van. Legyen tisztában az olyan kivételekkel, mint O, H, stb.
Határozza meg a vegyület többi elemének ismert oxidációs számát! Az oxidációs szám hozzárendelési szabályainak felhasználásával meghatározzuk, hogy a vegyület melyik atomjának hány oxidációs száma van. Legyen tisztában az olyan kivételekkel, mint O, H, stb. - Na2ÍGY4, szabályrendszerünk alapján tudjuk, hogy a Na-ion töltése (és így oxidációs száma) +1, és hogy az oxigénatomok oxidációs száma -2.
 Szorozza meg az egyes atomok számát az oxidációs számmal. Most, hogy ismerjük az összes atom oxidációs számát, az ismeretlen kivételével, figyelembe kell vennünk, hogy ezen atomok egy része többször is előfordulhat. Szorozzuk meg az egyes (a vegyületben található atom szimbóluma után indexben írt) együtthatókat az oxidációs számmal.
Szorozza meg az egyes atomok számát az oxidációs számmal. Most, hogy ismerjük az összes atom oxidációs számát, az ismeretlen kivételével, figyelembe kell vennünk, hogy ezen atomok egy része többször is előfordulhat. Szorozzuk meg az egyes (a vegyületben található atom szimbóluma után indexben írt) együtthatókat az oxidációs számmal. - Ami Na-t illeti2ÍGY4, tudjuk, hogy van 2 Na és 4 O atom. Most a következő számítást hajtjuk végre, 2 × +1, hogy megkapjuk a Na, 2 oxidációs számát, és megszorozzuk 4 × -2-t, az O, -8 oxidációs számát.
 Adja össze az eredményeket. Ezen szorzások eredményeinek összeadásával megkapjuk a vegyület oxidációs számát, nélkül figyelembe véve az ismeretlen atom oxidációs számát.
Adja össze az eredményeket. Ezen szorzások eredményeinek összeadásával megkapjuk a vegyület oxidációs számát, nélkül figyelembe véve az ismeretlen atom oxidációs számát. - Példánkban Na-val2ÍGY4, hozzáadunk 2-et -8-hoz, hogy a -6 értéket kapjuk.
 Számítsa ki az ismeretlen oxidációs számot a vegyület töltése alapján. Most már minden adata megvan ahhoz, hogy valamilyen egyszerű algebra segítségével megtalálja az ismeretlen oxidációs számot. Egy egyenletet és az előző lépés válaszát, valamint a vegyület töltését fogjuk használni. Más szavakkal: (Az ismeretlen oxidációs számok összege) + (az ismeretlen oxidációs szám, amelyet tudni szeretne) = (a vegyület töltése).
Számítsa ki az ismeretlen oxidációs számot a vegyület töltése alapján. Most már minden adata megvan ahhoz, hogy valamilyen egyszerű algebra segítségével megtalálja az ismeretlen oxidációs számot. Egy egyenletet és az előző lépés válaszát, valamint a vegyület töltését fogjuk használni. Más szavakkal: (Az ismeretlen oxidációs számok összege) + (az ismeretlen oxidációs szám, amelyet tudni szeretne) = (a vegyület töltése).- Na példáján2ÍGY4, ezt a következőképpen oldjuk meg:
- (Az ismert oxidációs számok összege) + (ismeretlen oxidációs szám, amelyet meg akar oldani) = (a vegyület töltése)
- -6 + S = 0
- S = 0 + 6
- S = 6. S oxidációs száma vagy 6 Na-ban2ÍGY4.
- Na példáján2ÍGY4, ezt a következőképpen oldjuk meg:
Tippek
- Az alapformájú atomok oxidációs száma mindig 0. Az 1 atomból álló ion oxidációs száma megegyezik a töltéssel. Az 1A. Csoportba tartozó fémek, például hidrogén, lítium és nátrium oxidációs száma +1; A 2A csoportba tartozó fémek, például a magnézium és a kalcium oxidációs száma +2. A hidrogénnek és az oxigénnek két különböző oxidációs száma lehet, kötésüktől függően.
- Egy vegyületben az összes oxidációs szám összegének egyenlőnek kell lennie 0. Ha van 2 atomos ion, akkor az oxidációs számok összegének meg kell egyeznie az ion töltésével.
- Nagyon hasznos tudni, hogyan kell olvasni a periódusos táblázatot, és hol lehet megtalálni a fémeket és a nemfémeket.
Szükségletek
- Az elemek periódusos táblázata
- Internet kapcsolat
- Kémiai könyv
- Papír, toll vagy ceruza
- Számológép



