Szerző:
Lewis Jackson
A Teremtés Dátuma:
8 Lehet 2021
Frissítés Dátuma:
25 Június 2024

Tartalom
A nettó ionegyenlet a kémia fontos része, mert csak azokat a részecskéket képviseli, amelyek egy kémiai reakció során megváltoznak. Leggyakrabban oxidációs-redukciós reakciókban, metabolikus reakciókban és savak - bázisok semlegesítési reakcióiban alkalmazzák. A nettó ionegyenlet három alapvető lépésből áll: kiegyensúlyozzuk a molekuláris egyenletet, konvertáljuk a teljes ionegyenletté (aszerint, hogy az egyes anyagok miként léteznek az oldatban), végül írjuk meg a nettó ionegyenletet.
Lépések
1/2 rész: Az ionegyenlet összetevőinek megértése
Ismerje a különbséget a molekulák és a ionos vegyületek. A nettó ionegyenlet megírásának első lépése a reakcióban lévő ionvegyületek meghatározása. Az ionos vegyületek azok, amelyek disszociálják az ionokat egy vizes oldatban és elektromos töltéssel rendelkeznek. A molekuláris vegyületek olyan vegyületek, amelyek soha nem rendelkeznek elektromos töltéssel. Két nemfém között képződnek, és néha kovalens vegyületeknek nevezik őket.
- Ionvegyületek képződhetnek fémek és nemfémek, fémek és többatomos ionok, vagy többszörös többatomos ionok között.
- Ha nem biztos abban, hogy mi az összetétel, megkeresheti az adott vegyület elemeit a periódusos rendszerben.

Ismerje fel egy vegyület oldhatóságát. Nem minden ionos vegyület oldódik vizes oldatban, ezért nem tud disszociálni ionokká. Az egyenlet többi részének folytatása előtt meg kell határoznia az egyes vegyületek oldhatóságát. Az alábbiakban összefoglaljuk az oldhatóság szabályait. További információkért és a szabályok alóli kivételekért keressen egy oldhatósági táblázatot.- Kövesse ezeket a szabályokat az alábbiakban ismertetett sorrendben:
- Minden Na-, K- és NH-só4 mind feloldódnak.
- Minden NEM só3, C2H3O2, ClO3és ClO4 mind feloldódnak.
- Minden Ag-, Pb- és Hg-só2 mind feloldódnak.
- Az összes Cl-, Br- és I-só oldható.
- Minden CO-só3, O, S, OH, PO4, CrO4, Kr2O7, és aztán3 oldódnak (néhány esetet kivéve).
- Minden SO-só4 mindegyik feloldódik (néhány esetet kivéve).
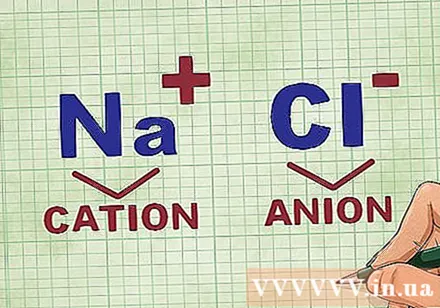
Kationok és anionok meghatározása egy vegyületben. A kationok a vegyületek pozitív ionjai, és általában a fémek. Az anion a vegyület negatív ionja és nem fémes. Egyes nemfémek alkothatnak kationokat, de a fémek mindig kationokat alkotnak.- Például NaCl-ban Na a pozitív töltésű kation, mivel fém, és Cl a negatív töltésű anion, mivel nemfém.

Ismerje fel a reakcióban a poliatomi ionokat. A poliatomi ionok olyan töltött molekulák, amelyek szorosan összekapcsolódnak, és nem disszociálnak a kémiai reakciók során. Fontos felismerni a többatomú ionokat, mert specifikus töltésűek és nem disszociálnak. A többatomos ionok pozitív vagy negatív töltéssel bírhatnak.- Ha általános kémiát tanul, gyakran meg kell emlékeznie néhány gyakori többatomú ionra.
- Néhány gyakori többatomú ion a CO3, NEM3, NEM2, ÍGY4, ÍGY3, ClO4 és ClO3.
- A kémiai könyvekben vagy az interneten számos más ion megtalálható.
2. rész: Nettó ionegyenlet megírása
A molekuláris egyenletek egyensúlya. A nettó ionegyenlet megírása előtt meg kell győződnie arról, hogy molekuláris egyenlete kiegyensúlyozott-e. Az egyenlet kiegyensúlyozásához együtthatókat ad hozzá az összetétel elé úgy, hogy az egyes elemek atomszáma egyenlő legyen az egyenlet mindkét oldalán.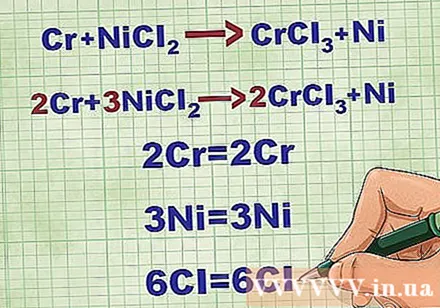
- Írja fel az egyes vegyületeket alkotó atomok számát az egyenlet mindkét oldalára!
- Adjon egy együtthatót az oxigéntől és a hidrogéntől eltérő elemek elé az egyes oldalak kiegyensúlyozásához.
- Hidrogénatom egyensúly.
- Oxigén atommérleg.
- Számolja fel az egyenletek mindkét oldalán levő atomok számát, hogy megbizonyosodjon arról, hogy kiegyensúlyozottak-e.
- Például Cr + NiCl2 -> CrCl3 + Ni 2Cr + 3NiCl-ra kiegyensúlyozott2 -> 2CrCl3 + 3Ni.
Azonosítsa a vegyület állapotát az egyenletben. A problémában sokszor vannak olyan kulcsszavak, amelyek tájékoztatják az egyes vegyületek állapotáról. Számos szabály segíti az elem vagy vegyület állapotának meghatározását.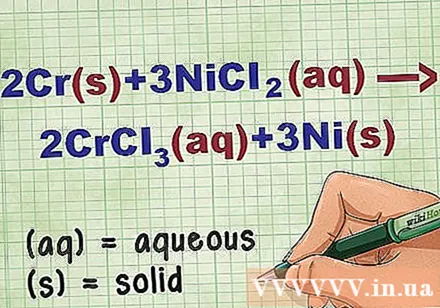
- Ha egy elem állapota nincs megadva, akkor használja a periódusos rendszerben található állapotot.
- Ha a vegyületet oldatnak hívják, vizes vagy (dd).
- Ha van víz az egyenletben, akkor az oldhatósági táblázat segítségével meg kell határoznia, hogy az ionos vegyület vízoldható-e. Ha az oldhatóság magas, a vegyület vizes lesz (dd), ha az oldhatóság alacsony, a vegyület szilárd lesz (r).
- Víz nélkül az ionos vegyület szilárd (r).
- Ha a probléma savas vagy lúgos, akkor a vegyület vizes (dd).
- Például 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. A Cr és Ni elemi formái szilárd állapotban vannak. NiCl2 és CrCl3 ionos vegyületek oldódnak, tehát vizesek. Írja át az egyenletet: 2Cr(r) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
Határozza meg, hogy melyik vegyületek disszociálnak (disszociálódnak kationokká és anionokká) az oldatban. Ha egy anyag vagy vegyület disszociál, akkor pozitív töltésű iongá (kation) és negatív töltésű iongá (anion) disszociál. Ezek azok az összetevők, amelyek egyensúlyba kerülnek a nettó ionegyenlet végén.
- A szilárd anyagok, folyadékok, gázok, molekuláris vegyületek, alacsony oldhatóságú ionos vegyületek, poliatomi ionok és gyenge savak nem disszociálnak.
- Az ionos vegyületek nagy oldhatósággal rendelkeznek (használja az oldhatósági táblázatot), és az erős savak 100% -ban ionizálódnak (HCl(dd), HBr(dd), SZIA(dd), H2ÍGY4(dd), HClO4(dd)és HNO3(dd)).
- Megjegyezzük, hogy bár a többatomos ionok már nem disszociálnak, ha ezek a vegyületek alkotórészei, akkor disszociálnak a vegyülettől.
Számítsa ki a vegyületből disszidált egyes ionok töltését. Ne feledje, hogy a fémek pozitív ionokat, a nemfémek pedig negatív ionokat képeznek. A periódusos táblázat segítségével meghatározhatja az elem töltését. Ki kell egyensúlyoznia a vegyületben lévő egyes ionok töltését is.
- Ebben a példában NiCl2 disszociálódott Ni-be és Cl-be, míg CrCl3 Cr-re és Cl-re osztva.
- A Ni töltése 2+, mivel Cl töltése negatív, de 2 atomja van. Ezért egyensúlyba kell hoznunk a 2 negatív Cl-iont. A Cr-nak 3+ töltése van, ezért egyensúlyba kell hoznunk a 3 negatív Cl-iont.
- Ne felejtsük el, hogy a többatomos ionoknak speciális töltésük van.
Írja fel a teljes ionegyenletet. Minden, ami disszociál vagy ionizál (erős savak), két különálló ionra válik szét. Az anyag állapota marad (dd), de ellenőrizze, hogy az egyenlet kiegyensúlyozott marad-e.
- A szilárd anyagok, folyadékok, gázok, gyenge savak és alacsony oldhatóságú ionos vegyületek nem változtatják meg az állapotukat, és nem válnak ionokká. Épségben tartjuk őket.
- A molekuláris anyagok diszpergálódnak oldatban, így állapotuk (dd). Három kivétel ők nem válik (dd) jelentése: CH4(k), C3H8(k)és C8H18(l).
- A fenti példával folytatva a teljes ionegyenlet így néz ki: 2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(r). Ha Cl nincs egy vegyületben, akkor az nem bipoláris, ezért a tényezőt megszorozzuk a vegyület atomjainak számával, hogy az egyenlet mindkét oldalán 6 Cl-iont kapjunk.
Távolítsa el az egyensúlyi ionokat úgy, hogy ugyanazokat az ionokat törli az egyenlet mindkét oldalán. Csak akkor törölheti, ha mindkét oldalon pontosan megegyeznek (töltés, atomszám stb.). Írja át az egyenletet a lebontható anyagok nélkül.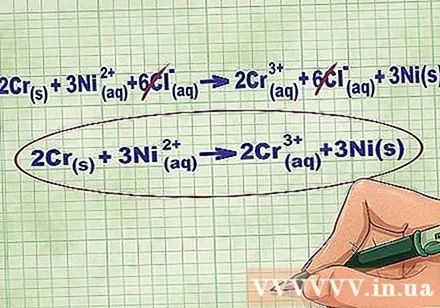
- A példa kitöltése után mindkét oldalon 6 törölhető Cl egyensúlyi ion található. A nettó ionegyenlet 2Cr(r) + 3Ni(dd) -> 2Cr(dd) + 3Ni(r).
- Ha igazad van, akkor a reaktáns oldali teljes töltésnek meg kell egyeznie a nettó ionegyenletben a termékoldal teljes töltésével.
Tanács
- Írja be az egyenletbe az összes anyag állapotát, ha nem maga akarat pontokat veszítenek.



