Szerző:
Christy White
A Teremtés Dátuma:
8 Lehet 2021
Frissítés Dátuma:
1 Július 2024
Tartalom
- Lépni
- 1/3 módszer: Első rész: Az elektronhéjak megértése
- 2/3 módszer: Második rész: Valencia elektronok keresése fémekben, az átmeneti fémek kivételével
- 3/3-as módszer: Harmadik rész: Valence-elektronok keresése az átmeneti fémekben
- Tippek
- Szükségletek
A valencia elektronok egy elem külső héjában fekszenek. Az atomban lévő vegyérték elektronok száma meghatározza a kémiai kötés típusát, amelyet ez az elem kialakíthat. A vegyérték elektronok számának megismerésére a legjobb módszer az elemek periódusos rendszerének használata.
Lépni
1/3 módszer: Első rész: Az elektronhéjak megértése
 Az elemek periódusos táblázata. Ez egy színkóddal ellátott táblázat, ahol minden cellában egy elem jelenik meg atomszámmal és 1-3 betűvel szimbólumként.
Az elemek periódusos táblázata. Ez egy színkóddal ellátott táblázat, ahol minden cellában egy elem jelenik meg atomszámmal és 1-3 betűvel szimbólumként.  Keresse meg az elem atomszámát. Az atomszám az elem szimbóluma felett vagy mellett található. Például: A bór (B) atomszáma 5, ami azt jelenti, hogy 5 protonja és 5 elektronja van.
Keresse meg az elem atomszámát. Az atomszám az elem szimbóluma felett vagy mellett található. Például: A bór (B) atomszáma 5, ami azt jelenti, hogy 5 protonja és 5 elektronja van.  Rajzoljon le egy egyszerű ábrázolást az atomról, és helyezze az elektronokat a mag körüli pályára. Ezeket a munkákat kagylónak vagy energiaszintnek is nevezik. Az azonos héjban lévő elektronok maximális száma rögzített, és a héjak a belső pályától a külső pályáig töltődnek.
Rajzoljon le egy egyszerű ábrázolást az atomról, és helyezze az elektronokat a mag körüli pályára. Ezeket a munkákat kagylónak vagy energiaszintnek is nevezik. Az azonos héjban lévő elektronok maximális száma rögzített, és a héjak a belső pályától a külső pályáig töltődnek. - K héj (belső): maximum 2 elektron.
- L Héj: maximum 8 elektron.
- M Shell: Legfeljebb 18 elektron.
- N Shell: Legfeljebb 32 elektron.
- O Héj: legfeljebb 50 elektron.
- P héj (külső): legfeljebb 72 elektron.
 Keresse meg a külső héjon lévő elektronok számát. Ezek a vegyérték elektronok.
Keresse meg a külső héjon lévő elektronok számát. Ezek a vegyérték elektronok. - Ha a vegyérték héja megtelt, az elem stabil.
- Ha a vegyértékhéj nem teljes, akkor az elem reaktív, ami azt jelenti, hogy kémiailag kötődhet egy másik elem atomjához. Minden atom megosztja vegyérték-elektronjait, megkísérelve, hogy a vegyérték-héj tele legyen.
2/3 módszer: Második rész: Valencia elektronok keresése fémekben, az átmeneti fémek kivételével
 Számozza meg a periódusos rendszer minden oszlopát 1-től 18-ig. A hidrogén (H) az 1. oszlop tetején, a hélium (He) a 18. oszlop tetején található. Ezek a különböző elemcsoportok.
Számozza meg a periódusos rendszer minden oszlopát 1-től 18-ig. A hidrogén (H) az 1. oszlop tetején, a hélium (He) a 18. oszlop tetején található. Ezek a különböző elemcsoportok.  Adjon minden sornak 1-től 7-ig számot. Ezek az elemek periódusai, és megfelelnek egy atom héjának vagy energiaszintjének.
Adjon minden sornak 1-től 7-ig számot. Ezek az elemek periódusai, és megfelelnek egy atom héjának vagy energiaszintjének. - A hidrogénnek (H) és a héliumnak (He) egyaránt 1 héja van, míg a Franciumnak (Fr) 7.
- A lantanidok és az aktinidek a fő táblázat alatt vannak csoportosítva és felsorolva. Valamennyi lantanid a 6., a 3. csoportba tartozik, és az összes aktinid a 7. periódus 3. csoportjába tartozik.
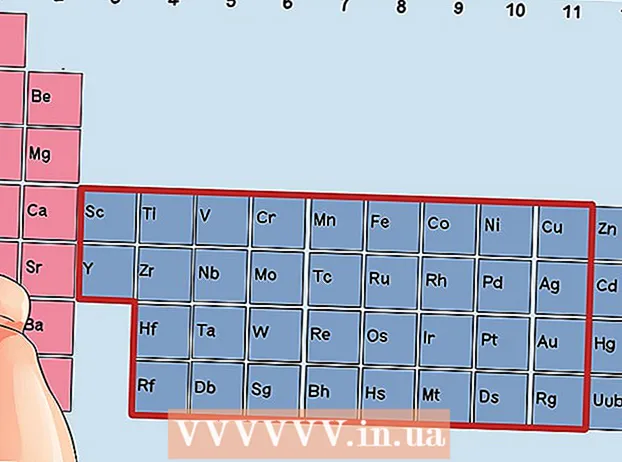
 Keressen olyan elemet, amely nem átmeneti fém. Az átmenetifémek a 3–12 csoportokba tartoznak. A többi fém csoportszáma a vegyérték elektronok számát jelzi.
Keressen olyan elemet, amely nem átmeneti fém. Az átmenetifémek a 3–12 csoportokba tartoznak. A többi fém csoportszáma a vegyérték elektronok számát jelzi. - 1. csoport: 1 vegyérték elektron
- 2. csoport: 2 vegyérték elektron
- 13. csoport: 3 vegyérték elektron
- 14. csoport: 4 vegyérték elektron
- 15. csoport: 5 vegyérték elektron
- 16. csoport: 6 vegyérték elektron
- 17. csoport: 7 vegyérték elektron
- 18. csoport: 8 vegyértékű elektron - kivéve a héliumot, amelynek 2 van
3/3-as módszer: Harmadik rész: Valence-elektronok keresése az átmeneti fémekben
 Keressen egy elemet a 3–12. Csoportból, az átmenetifémeket.
Keressen egy elemet a 3–12. Csoportból, az átmenetifémeket. Határozza meg a vegyérték elektronok számát a csoportszám alapján. Ezek a csoportszámok a vegyérték elektronok lehetséges számának felelnek meg.
Határozza meg a vegyérték elektronok számát a csoportszám alapján. Ezek a csoportszámok a vegyérték elektronok lehetséges számának felelnek meg. - 3. csoport: 3 vegyérték elektron
- 4. csoport: 2–4 vegyértékű elektron
- 5. csoport: 2–5 vegyértékű elektron
- 6. csoport: 2–6 vegyértékű elektron
- 7. csoport: 2-7 vegyérték elektron
- 8. csoport: 2 vagy 3 vegyértékű elektron
- 9. csoport: 2 vagy 3 vegyértékű elektron
- 10. csoport: 2 vagy 3 vegyértékű elektron
- 11. csoport: 1 vagy 2 vegyértékű elektron
- 12. csoport: 2 vegyérték elektron
Tippek
- Az átmenetifémeknek lehetnek valens héjai, amelyek nem teljesen tele vannak. Az átmenetifémekben a vegyérték elektronok pontos számának meghatározásához a kvantumelmélet bizonyos alapelvei szükségesek, amelyek túlmutatnak a cikk keretein.
Szükségletek
- Az elemek periódusos táblázata
- Ceruza
- Papír