Szerző:
Helen Garcia
A Teremtés Dátuma:
17 Április 2021
Frissítés Dátuma:
1 Július 2024
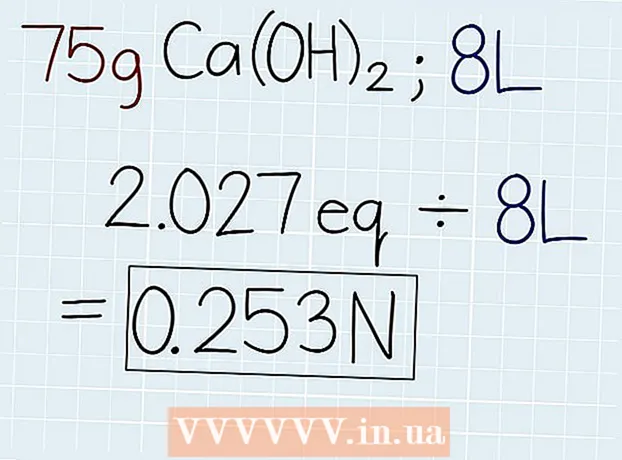
Tartalom
- Lépések
- 1 /2 -es módszer: A normalitás kiszámítása a molaritással
- 2. módszer 2 -ből: A normalitás kiszámítása egyenértékű tömegben
- Tippek
- Mire van szükséged
A normalitás a sav vagy lúg koncentrációját jelzi az oldatban. Az oldat normalitásának megállapításához a molaritás és a molekula ekvivalens tömege egyaránt használható a számítások során. Ha a molaritás használata mellett dönt, használja az N = M (n) képletet, ahol M a molaritás, és n a hidrogén- vagy hidroxidmolekulák száma. Ha az ekvivalens tömeg alkalmazása mellett dönt, használja az N = eq ÷ V képletet, ahol eq az egyenértékek száma és V az oldat térfogata.
Lépések
1 /2 -es módszer: A normalitás kiszámítása a molaritással
 1 Összeadjuk az oldat összes összetevőjének moláris tömegét. Keresse meg a periódusos táblázatban a kémiai képlet elemeit, hogy megtudja atomtömegüket, amely megfelel a moláris tömegnek. Írja fel az egyes elemek moláris tömegét, és szorozza meg az elemek számával. Összeadva az összes komponens moláris tömegét a teljes moláris tömeg megtalálásához.
1 Összeadjuk az oldat összes összetevőjének moláris tömegét. Keresse meg a periódusos táblázatban a kémiai képlet elemeit, hogy megtudja atomtömegüket, amely megfelel a moláris tömegnek. Írja fel az egyes elemek moláris tömegét, és szorozza meg az elemek számával. Összeadva az összes komponens moláris tömegét a teljes moláris tömeg megtalálásához. - Például, ha tudni szeretné a kénsav (H2ÍGY4), határozza meg a hidrogén (1 g), a kén (3 g) és az oxigén (16 g) moláris tömegét.
- Szorozzuk meg a tömeget a készítményben lévő összetevők számával. Példánkban 2 hidrogénatom és 4 oxigénatom található. A hidrogén teljes moláris tömege 2 x 1 g = 2 g, ebben az oldatban az oxigén moláris tömege 4 x 16 g = 64 g.
- Add hozzá az összes moláris tömeget. 2 g + 32 g + 64 g = 98 g / mol értéket kap.
- Ha már ismeri a keresett megoldás molaritását, folytassa közvetlenül a 4. lépéssel.
 2 Ossza el az oldat tényleges tömegét a moláris tömeggel. Ismerje meg a megoldás tényleges súlyát. Ezt vagy az oldatot tartalmazó tartályon, vagy magában a feladatban kell feltüntetni.Ezután ossza el az oldat tömegét a korábban talált teljes moláris tömeggel. Az eredmény az oldatban lévő mólok száma lesz, amely után fel kell írni a „mol” -t.
2 Ossza el az oldat tényleges tömegét a moláris tömeggel. Ismerje meg a megoldás tényleges súlyát. Ezt vagy az oldatot tartalmazó tartályon, vagy magában a feladatban kell feltüntetni.Ezután ossza el az oldat tömegét a korábban talált teljes moláris tömeggel. Az eredmény az oldatban lévő mólok száma lesz, amely után fel kell írni a „mol” -t. - Például, ha 100 g H normálitását próbálja megtudni2ÍGY412 liter folyadékban feloldva használja a tényleges tömeget, és ossza el molárisan. Ennek eredményeként a következőket kapja: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 mól 6,02 x 10 atom vagy oldatmolekula.
 3 Ossza el az eredményt az oldat térfogatában literben, hogy megtudja a molaritást. Vegye ki a mól számát az oldatban, és számítsa ki a mért oldat teljes térfogatával. Ennek eredményeként ismerni fogja a molaritást (M), amellyel megtudhatja az oldat koncentrációját.
3 Ossza el az eredményt az oldat térfogatában literben, hogy megtudja a molaritást. Vegye ki a mól számát az oldatban, és számítsa ki a mért oldat teljes térfogatával. Ennek eredményeként ismerni fogja a molaritást (M), amellyel megtudhatja az oldat koncentrációját. - Példánk alapján a következő képletet kapjuk: 1,02 mol ÷ 12 L = 0,085 M.
Tanács: feltétlenül alakítsa át az oldat térfogatát literre, ha még nem tette meg. Ellenkező esetben rossz választ kap.
 4 Szorozzuk meg a molaritást a hidrogén- vagy hidroxidmolekulák számával. Vessen egy pillantást a kémiai képletre, hogy megtudja a hidrogénatomok számát (H) egy savas vagy hidroxid molekulában a (OH) bázisban. Ezután megszorozzuk az oldat molaritását az oldatban lévő hidrogén- vagy hidroxidmolekulák számával, hogy megtaláljuk a normális koncentrációt vagy normálist. A válasz végén írja be az "N" rövidítést.
4 Szorozzuk meg a molaritást a hidrogén- vagy hidroxidmolekulák számával. Vessen egy pillantást a kémiai képletre, hogy megtudja a hidrogénatomok számát (H) egy savas vagy hidroxid molekulában a (OH) bázisban. Ezután megszorozzuk az oldat molaritását az oldatban lévő hidrogén- vagy hidroxidmolekulák számával, hogy megtaláljuk a normális koncentrációt vagy normálist. A válasz végén írja be az "N" rövidítést. - Példánkban a kénsav (H2ÍGY4) 2 hidrogénatom. Tehát a képlet a következő lesz: 0,085 M x 2 = 0,17 N.
- Egy másik példában a 2 M molaritású nátrium -hidroxid (NaOH) csak 1 hidroxid molekulával rendelkezik. Ezért a képlet a következő lesz: 2 M x 1 = 2 N.
2. módszer 2 -ből: A normalitás kiszámítása egyenértékű tömegben
 1 Ismerje meg az oldat teljes moláris tömegét. Vessen egy pillantást az oldat kémiai képletére, és keresse meg az egyes elemeket a periódusos rendszerben. Írja fel az egyes elemek moláris tömegét, és szorozza meg a képletben szereplő elemek számával. Az összes moláris tömeget összeadva megkapjuk a teljes moláris tömeget grammban.
1 Ismerje meg az oldat teljes moláris tömegét. Vessen egy pillantást az oldat kémiai képletére, és keresse meg az egyes elemeket a periódusos rendszerben. Írja fel az egyes elemek moláris tömegét, és szorozza meg a képletben szereplő elemek számával. Az összes moláris tömeget összeadva megkapjuk a teljes moláris tömeget grammban. - Például, ha tudni szeretné a Ca (OH) moláris tömegét2, majd megtudja a kalcium (40 g), az oxigén (16 g) és a hidrogén (1 g) moláris tömegét.
- A képletben 2 atom oxigén és hidrogén van. Az oxigén teljes tömege: 2 x 16 g = 32 g, A hidrogén moláris tömege: 2 x 1 g = 2 g.
- Az összes móltömeget összeadva 40 g + 32 g + 2 g = 74 g / mol értéket kapunk.
 2 Ossza el a moláris tömeget a hidrogén- vagy hidroxidmolekulák számával. Ismerje meg a hidrogénatomok (H) számát a bázisban lévő savas vagy hidroxid (OH) molekulákban. Ossza el az imént kapott teljes moláris tömeget az atomok vagy molekulák számával, hogy megkapja az 1 ekvivalens tömegét, amely megegyezik 1 mól hidrogén vagy hidroxid tömegével. A válasz végén írja be a "G.-e." rövidítést, ami az egyenérték tömegét jelenti.
2 Ossza el a moláris tömeget a hidrogén- vagy hidroxidmolekulák számával. Ismerje meg a hidrogénatomok (H) számát a bázisban lévő savas vagy hidroxid (OH) molekulákban. Ossza el az imént kapott teljes moláris tömeget az atomok vagy molekulák számával, hogy megkapja az 1 ekvivalens tömegét, amely megegyezik 1 mól hidrogén vagy hidroxid tömegével. A válasz végén írja be a "G.-e." rövidítést, ami az egyenérték tömegét jelenti. - Példánkban a Ca (OH)2 2 két hidrogénmolekula, ami azt jelenti, hogy az egyenérték tömege 74 g / mol ÷ 2 = 37 G.-e.
 3 Ossza el az oldat tényleges tömegét az egyenértékű tömeggel. Miután megtudta az egyenérték tömegét, ossza el az oldat tömegével, amely az oldatot tartalmazó tartályon vagy a megoldandó feladatban van feltüntetve. A válasz az egyenértékűek száma lesz a megoldásban, hogy aztán kiszámíthassa a normalitást. A válasz végén írja be az "e" rövidítést.
3 Ossza el az oldat tényleges tömegét az egyenértékű tömeggel. Miután megtudta az egyenérték tömegét, ossza el az oldat tömegével, amely az oldatot tartalmazó tartályon vagy a megoldandó feladatban van feltüntetve. A válasz az egyenértékűek száma lesz a megoldásban, hogy aztán kiszámíthassa a normalitást. A válasz végén írja be az "e" rövidítést. - Példánkban 75 g Ca (OH)2, akkor a képlet a következő lesz: 75 g ÷ 37 G.-e = 2,027 Oe.
 4 Ossza el az egyenértékek számát az oldat térfogatával literben. Keresse meg az oldat teljes térfogatát, és írja le a választ literben. Vegye ki a kapott egyenértékek számát, és ossza el az oldat térfogatával, hogy megtudja a normalitást. A válasz végén tegyen egy rövidítést "N".
4 Ossza el az egyenértékek számát az oldat térfogatával literben. Keresse meg az oldat teljes térfogatát, és írja le a választ literben. Vegye ki a kapott egyenértékek számát, és ossza el az oldat térfogatával, hogy megtudja a normalitást. A válasz végén tegyen egy rövidítést "N". - Ha 75 g Ca (OH) van 8 literes oldatban2, majd ossza el az egyenértékűek számát a térfogattal a következő módon: 2.027 Oe. ÷ 8 l = 0,253 N.
Tippek
- A savak és bázisok mérésére általában a normál koncentrációt vagy a normalitást használják. Ha meg kell határoznia egy másik oldat koncentrációját, ezt általában a molaritás mérésével kell elvégezni.
Mire van szükséged
- Periódusos táblázat
- Számológép